
1 活化參數的引進
前面得到的過渡態理論的基本方程(1)(為了格式統一將原來的?G≠改為?G≠)中的傳輸系數κ很難通過計算或者測量得到,因此這里需要定義一個假熱力學平衡常數K≠。將方程(2)帶入(1)可得方程式(3)。
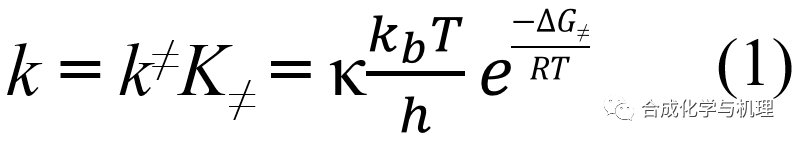

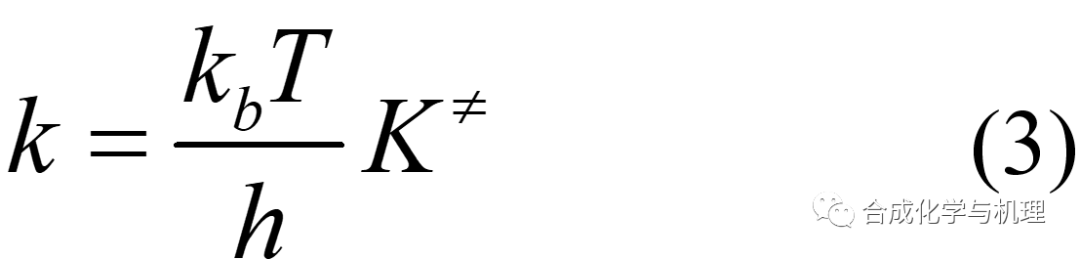
基于熱力學公式(4)和(5),可得方程式(6)—(8)。其中△G≠,△H≠和△S≠都是熱力學量。這樣就將動力學量k與熱力學量聯系起來了。測定k與溫度T的關系,就可計算△G≠,△H≠和△S≠,進而推斷反應機理。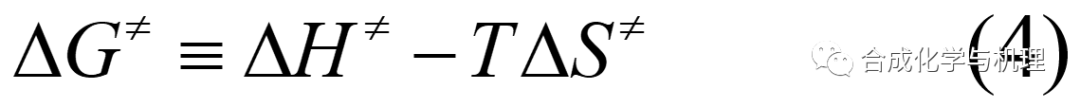
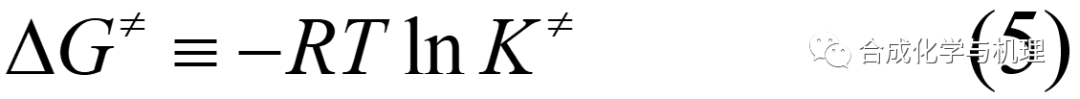
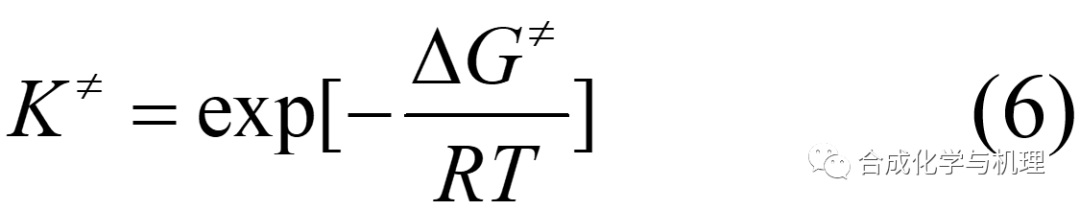
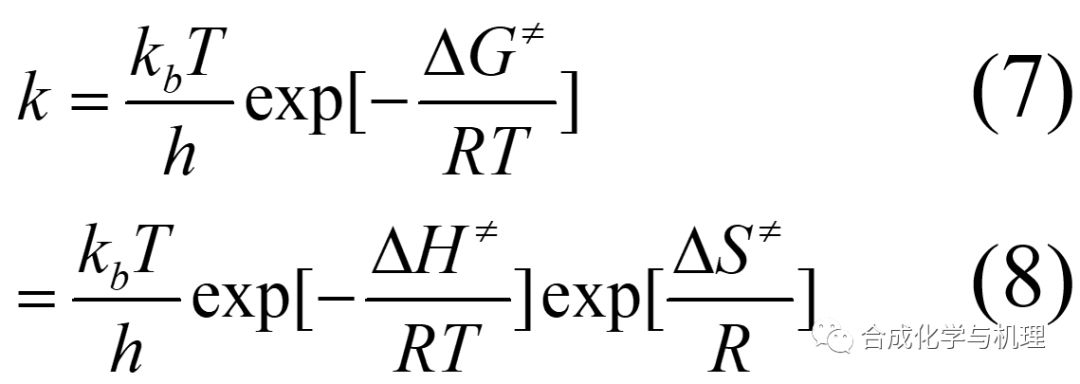
2 活化參數的計算
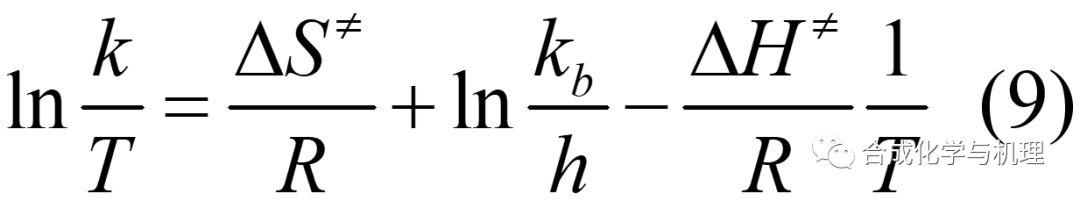
其中R = 8.314 J/mol K;h = 6.523×10-27 erg/s;kb = 1.38×10-16 erg/s;1 erg/s = 1 g·cm2/s3 = 10?7 W。
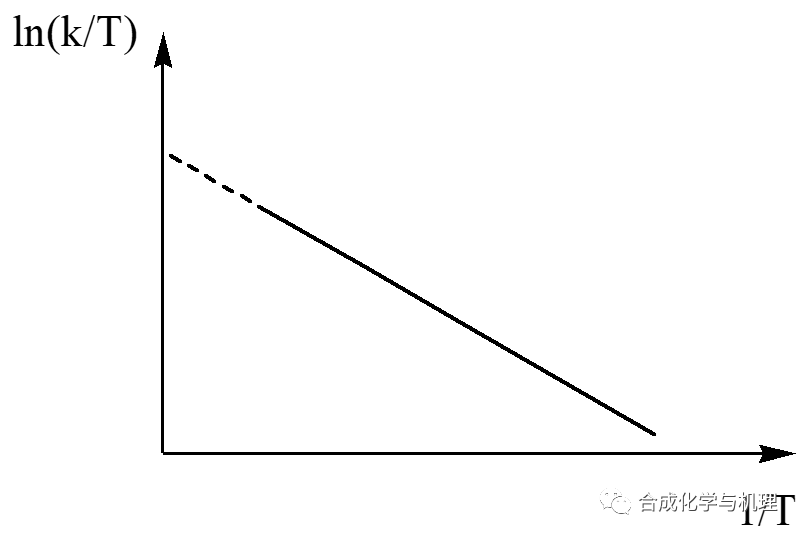
由公式(8)可得方程式(9),根據不同溫度下測定的速率常數k計算出ln(k/T)和1/T。以ln(k/T)對1/T作圖(如下圖所示)。如果得到直線,則由直線的斜率和截距可分別求出△H≠和△S≠。由于△H≠值是由直線的斜率求出的,其值的大小與速率常數k的單位無關。△S≠是由截距求出的,其值的大小與速率常數k的單位有關。
3 △H≠與反應機理
△H≠與反應的能壘有關,根據△H≠值的大小,可以判斷反應中鍵的斷裂程度。如果反應中,鍵的斷裂和鍵的生成同時發生,斷裂舊鍵所需要的能量可以由生成新鍵所釋放的能量來補償,因而△H≠值較小。如果反應的速率控制步驟有鍵的斷裂,又沒有新鍵的形成來補償舊鍵斷裂的能量消耗,△H≠值就會比較高。
實例1
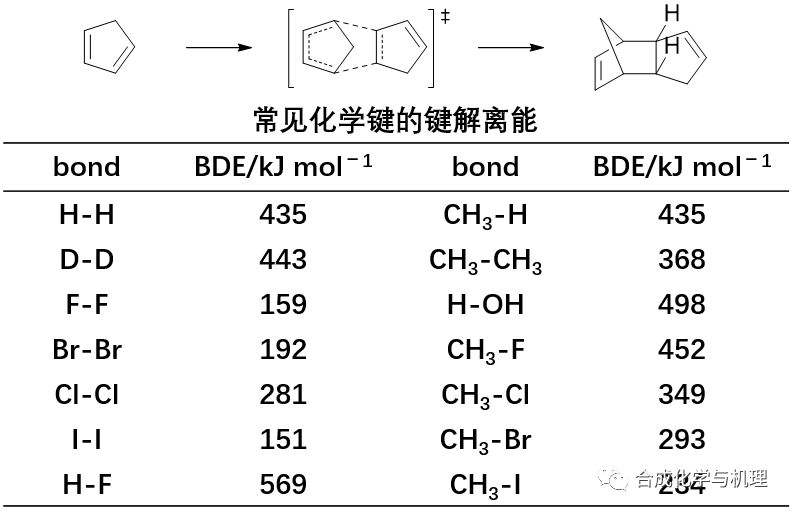
環戊二烯的二聚反應,△H≠值為64.8 kJ·mol-1,遠小于常見化學鍵的鍵能,所以該反應決速步同時包含鍵的斷裂和生成,為協同機理。
實例2
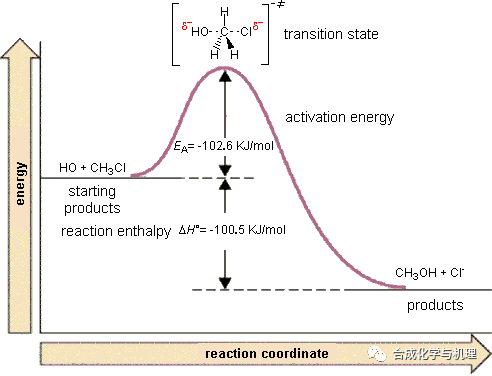
氯仿水解生成甲醇的親核取代反應,△H≠值為100.5 kJ·mol-1,遠小于常見化學鍵的鍵能,所以該反應決速步同時包含鍵的斷裂和生成,為協同機理,即SN2機理。
4 △S≠與反應機理
△S≠反映了從反應物到過渡態體系有序性的變化。根據△S≠的大小和正負,可以推測過渡態的結構及其所帶的電荷以及是否存在溶劑化效應等。如果從反應物到過渡態體系的有序性增加,如形成環狀過渡態,體系的熵就會減少,因而有△S≠ < 0。如果從反應物到過渡態有鍵的斷裂,導致體系的有序性降低,體系的熵就會增加,因而有△S≠ > 0。
實例3
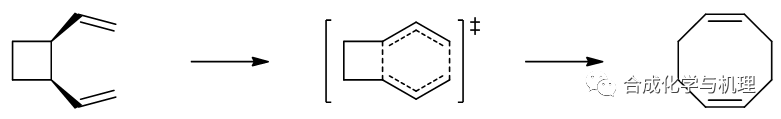
1,2-二乙烯基環丁烷的cope重排反應△S≠ = -48.9 J·mol-1·K-1,說明該反應是典型的協同反應。
實例4
1,1’-偶氮丁烷的氣相熱分解,△S≠= 79.5J·mol-1·K-1 > 0,表明C-N鍵的斷裂是反應的速率控制步驟。
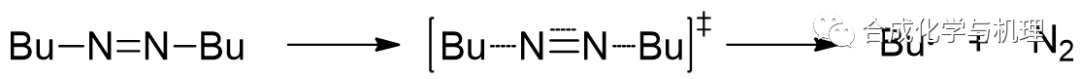
對于液相反應用活化熵解釋反應機理時,要同時分析溶劑化效應對活化熵的影響。特別是對于從反應物到過渡態有電荷生成的反應,過渡態的溶劑化程度往往比反應物大,導致體系的熵減小,使△S≠ < 0
實例5
鹵代烷的SN1親核取代反應
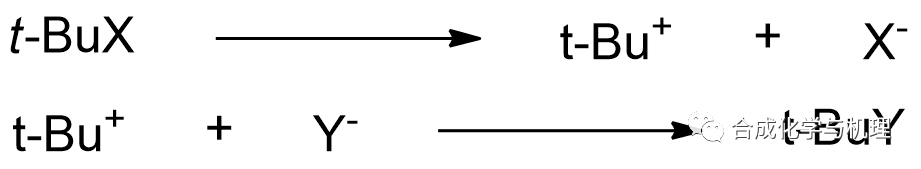
如果僅從反應物和過渡態的有序性考慮,過渡態有鍵的斷裂,有序性降低,應有△S≠ > 0。實際上,在80%乙醇水溶液中反應時,實驗測定的△S≠為-27.6 J·mol-1·K-1 < 0(具體見前面介質效應的內容)。
5 △V≠<span style="max-width: 100%;background-image: initial;background-position: initial;background-size: initial;background-repeat: initial;bac








