分享一篇發表在Angew. Chem. Int. Ed.上的文章,通訊作者是來自中國科學院上海藥物研究所的陳小華、譚敏佳、李佳老師,主要研究方向是基于蛋白組學技術的蛋白修飾調控和藥物精準干預。

分子膠(molecular glues, MGs)與蛋白質結合后可以重塑其表面,故而可以誘導蛋白質和蛋白質產生新的相互作用(neo protein-protein interactions, neoPPIs),從而對多種生物過程進行人工干預。其中MG降解劑是進行靶向蛋白質降解(targeted protein degradation, TPD)的有效工具,其中最經典的例子就是通過分子膠誘導E3連接酶和靶蛋白產生相互作用,促進靶蛋白的泛素化,最后將其引導至蛋白酶體降解途徑。
鑒定由MG降解劑誘導的E3連接酶新型底物對理解它們發揮作用的機制十分重要,我們將這些新型底物的總和(包括被降解的底物和不能被降解但仍能和E3連接酶產生相互作用的底物)稱為MG降解劑的靶標空間。而目前一些用于分析PPI的方法,如免疫共沉淀或親和純化質譜(coIP/AP-MS)和基于酶的鄰近標記質譜(PL-MS)都存在各自的限制。因此,作者計劃將遺傳密碼子擴展技術和基于質譜的蛋白質組學技術相結合,將可用于交聯的非天然氨基酸(unnatural amino acids, UAAs)摻入可被MG降解劑DKY709作用的cereblon(CRBN)蛋白中,鑒定其被誘導產生的新型相互作用組。
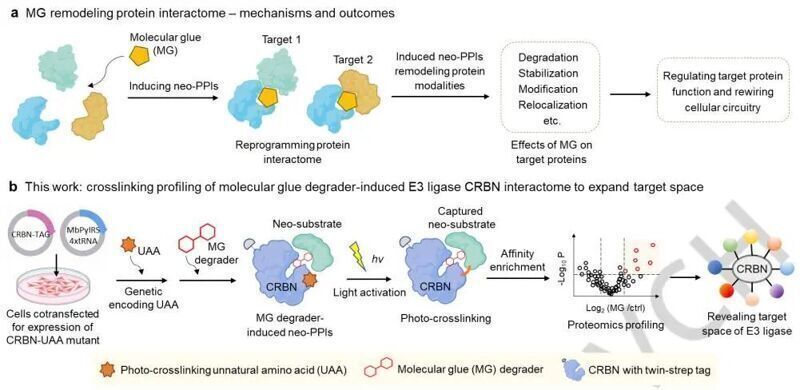
作者首先根據CRBN-CC-885-GSPT1復合物的結構設計插入位點,將鄰硝基芐醇衍生的賴氨酸(o-NBAK,可交聯附近賴氨酸)插入到CRBN中,隨后用MG CC-885處理細胞,然后進行光交聯,對交聯得到的E3連接酶-底物復合物進行親和富集、消化,得到的肽段樣本使用數據非依賴性采集質譜(DIA-MS)進行分析,作者成功鑒定到了GSPT1在MG孵育條件下的富集,成功進行了概念驗證。隨后作者又嘗試了非特異性光交聯UAA, AbK進行測試。
接下來,作者將該方法應用于已進入臨床試驗的MG降解劑DKY709的靶標鑒定。作者在HEK293T細胞中進行分析,并鑒定到了49個在DKY709處理后顯著富集的蛋白。作者選擇其中的FIZ1蛋白進行驗證,通過免疫印跡分析證明了它在DKY709處理后依賴于泛素蛋白酶體系統的降解。同時作者還發現了DKY709的非降解靶標MNAT1。
隨后作者根據CRBN和來那度胺以及靶蛋白的共晶結構設計了兩種新型MG CM-2和CM-3,他們可以和CRBN表面額外的半暴露口袋結合,分子對接實驗證實了這一點。作者隨后證明了他們可以抑制多發性骨髓瘤細胞系MM.1S的生長,并同樣進行了交聯測試,鑒定了其靶蛋白。
總之,作者利用遺傳密碼子擴展技術和基于質譜的蛋白質組學技術,鑒定了CRBN蛋白被MG降解劑誘導產生的新型相互作用蛋白,并開發了兩種新型的MG降解劑。
本文作者:ZCL
責任編輯:LZ
DOI:10.1002/anie.202505053
原文鏈接:https://doi.org/10.1002/anie.202505053








