程序性死亡配體1(PD-L1)是腫瘤細胞表面的關鍵免疫檢查點蛋白,通過與T細胞上的PD-1結合抑制抗腫瘤免疫應答,免疫檢查點阻斷療法在臨床上已經取得了重要成果。
盡管PD-L1/PD-1抗體療法已取得臨床成功,但PD-L1作為典型的膜蛋白具有動態循環(內吞-再表達)特征,導致抗體阻斷效果不佳。另外,PD-L1在正常組織中廣泛表達,導致正常組織的免疫毒性。近年來,盡管靶向蛋白降解技術發展迅速,如LYTACs依賴溶酶體靶向受體(LTRs)和目標蛋白,但LTRs缺乏腫瘤特異性,可能引發全身性副作用。因此,開發一種能夠選擇性降解腫瘤PD-L1且不干擾正常組織的技術具有重要意義。
近日,華東師范大學徐志愛教授團隊提出了一種模塊化合成的新型聚合物多價靶向嵌合體(multi-TACs),實現腫瘤微環境(TME)特異性激活并降解PD-L1。

Multi-TACs通過引入pH敏感的三級胺基團,在腫瘤微酸性環境下質子化,觸發納米顆粒解離并暴露PD-L1配體BMS-1,特異性結合膜蛋白PD-L1。并通過調節BMS-1的價態、BMS-1與聚合物骨架的長度和腫瘤微環境響應基團類型,篩選出腫瘤MMP-2酶和胞外酸(pH 6.8-pH 6.4)雙響應的multi-TACs GG56,其表現出了良好的PD-L1降解效果。并發現GG56通過與細胞膜的靜電作用及PEG脫殼的作用促進了PD-L1降解。
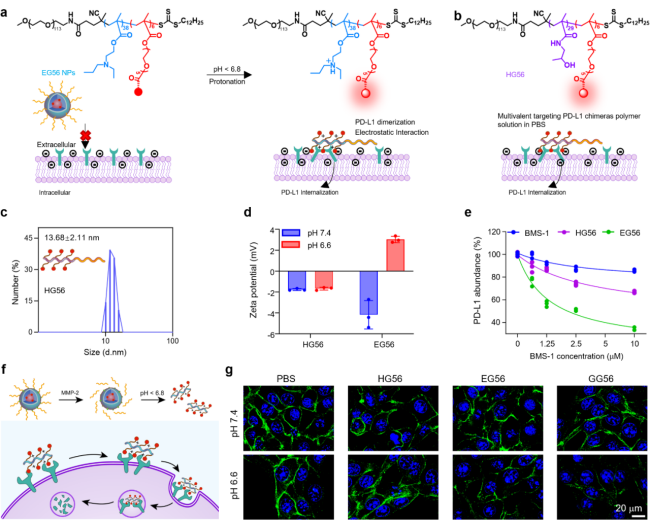
GG56與傳統LTR依賴的降解技術機制不同,通過脂筏和巨胞飲途徑介導入胞作用促進PD-L1-multi-TAC復合物內化,并經由溶酶體途徑高效降解,且不依賴PD-L1之外的特定膜受體。
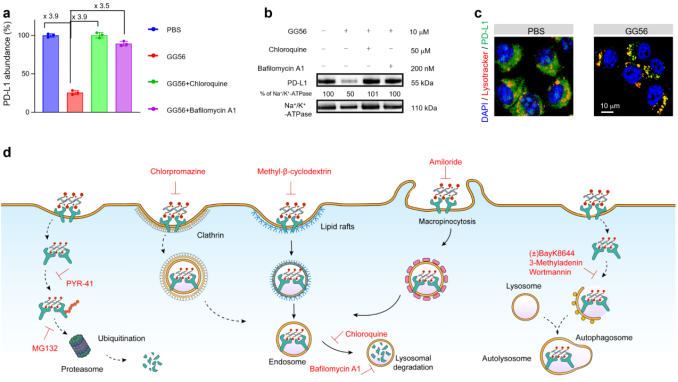
在該工作中,徐志愛教授團隊發展了新型膜蛋白降解技術平臺,以典型膜蛋白PD-L1為例,構建具有結構可調的PD-L1多價抑制劑,實現腫瘤微環境特異性降解PD-L1而不依賴于其他膜受體,降低了正常組織的毒副作用。
論文信息
De Novo Design of Structure-Tunable Multivalent Targeting Chimeras for Tumor-Targeted PD-L1 Degradation and Potentiated Cancer Immunotherapy
Huiling Zhou, Bo Hou, Yiming Shan, Lujia Huang, Fangmin Chen, Siyuan Ren, Shunan Zhang, Jiaxing Pan, Yijing Dang, Haijun Yu, Zhiai Xu
Angewandte Chemie International Edition
DOI: 10.1002/anie.202504233








