自Barton脫羧反應以來,羧酸自由基脫羧官能團化反應有了長足發展。近年來,光氧化還原催化脂肪酸及活化酯的脫羧官能團化反應由于條件溫和、底物耐受性廣等優勢受到廣泛關注。但是,通過這些方法生成羧基自由基仍需通過氧化還原途徑,因此不可避免地需要氧化劑或還原劑。通過氫轉移(HAT)生成羧基自由基是一種氧化還原中性的方法,能解決對氧化還原條件敏感底物不適用的問題。但是,開發這類反應必然面對的問題是,相較烷烴C-H鍵的鍵解離能(BDE, 96-101 kcal/mol),羧基O-H鍵具有更高的BDE(~112 kcal/mol),使得羧基O-H鍵很難發生均裂。近日,北卡羅萊納大學教堂山分校Erik J. Alexanian教授課題組發展了一種N-黃原酰基五氟苯甲酰胺自由基選擇性與羧基O-H鍵發生HAT生成羧基自由基,繼而發生自由基脫羧和自由基重組生成黃原酸酯的新反應(Figure 1)。該反應適用于包含復雜生物分子在內的多種脂肪酸。通過機理研究實驗及理論計算,作者發現,較苯磺酰胺而言,苯甲酰胺的N-H鍵具有更高的BDE,使其與羧酸O-H鍵的HAT能順利發生。相關內容發表在J. Am. Chem. Soc.(DOI: 10.1021/jacs.9b10825)上。
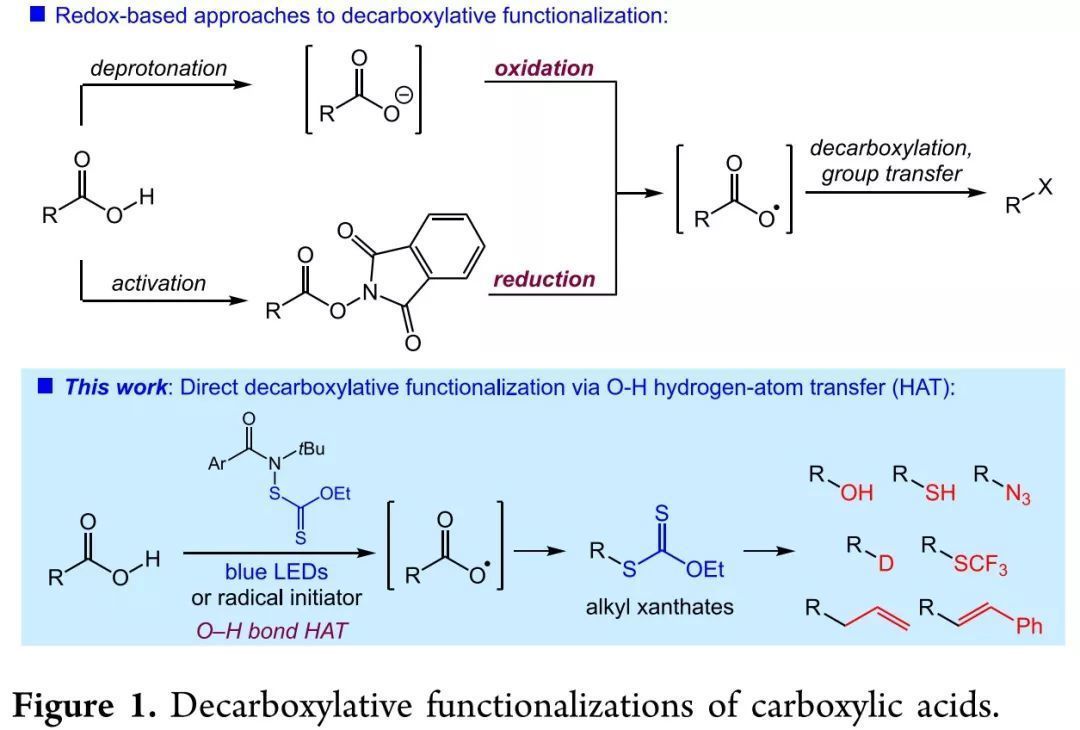
(圖片來源:J. Am. Chem. Soc.)
作者首先以正己酸的轉化為模型反應對反應條件進行了探索(Table 1)。在440 nm藍光激發下,以酰胺1為HAT試劑能以59%的收率得到脫羧產物;使用過氧化二月桂酰為自由基引發劑時收率降低;在藍光激發下,將HAT試劑換為N-黃原酰基五氟苯甲酰胺2時效率大大增加,增加試劑2至1.2當量時能得到更好的結果;自由基激發條件換為過氧化二月桂酰時效率略降低,通過控制實驗,作者發現當以羧酸鹽為底物或無自由基引發條件下無反應發生。
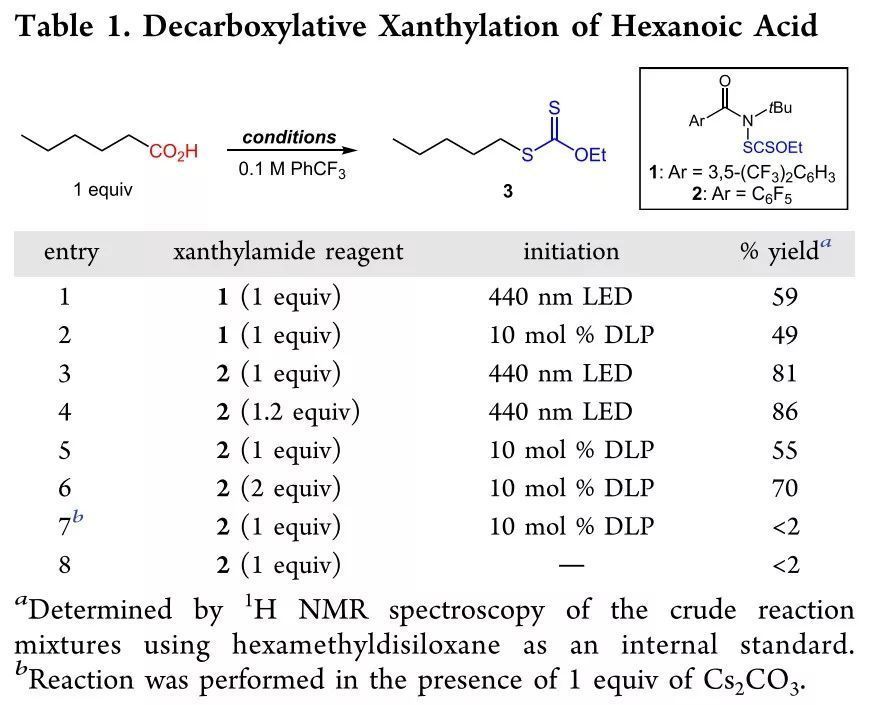
(圖片來源:J. Am. Chem. Soc.)
確立反應條件后,作者對發展的脫羧黃原酸酯化的底物適用性進行了研究(Figure 2)。結果表明,一級、二級、三級羧酸對該反應表現出了良好的耐受性。其中,一級羧酸中的溴、酯基、烯基,N-Boc吲哚對該反應兼容;二級羧酸中,內式降冰片烷羧酸只產生外式黃原酸酯12,而1,4-環己二羧酸生成了一對非對映異構體13;三級羧酸同樣高收率地轉化為相應的黃原酸酯,其中,具有挑戰性的酮基蒎酸能通過橋頭自由基生成產物21。該方法還可用于天然產物及藥物分子的后期修飾。凝血酸能以90%收率生成一對非對映異構體22。布洛芬和吲哚美辛由于芐基自由基的穩定性,使得黃原酸酯轉移過程可逆,收率降低。萜類和甾體化合物同樣能發生反應,在轉化中,羥基、烯酮官能團不受影響。乙酰化赤霉素能夠以較高收率生成單一異構體30。氨基酸也能發生反應,其中谷氨酸的黃原酸酯化產物能作為平臺分子進行氨基酸后期修飾及非天然氨基酸合成。作者同樣嘗試了三肽的脫羧黃原酸酯化,并以優秀的回收產率得到黃原酸酯。以半胱氨酸為代表,巰基氨基酸多肽化學中具有包括自然化學連接法(NCL)在內的多種作用,因此脫羧黃原酸酯化能夠為蛋白化學的研究提供新方法。
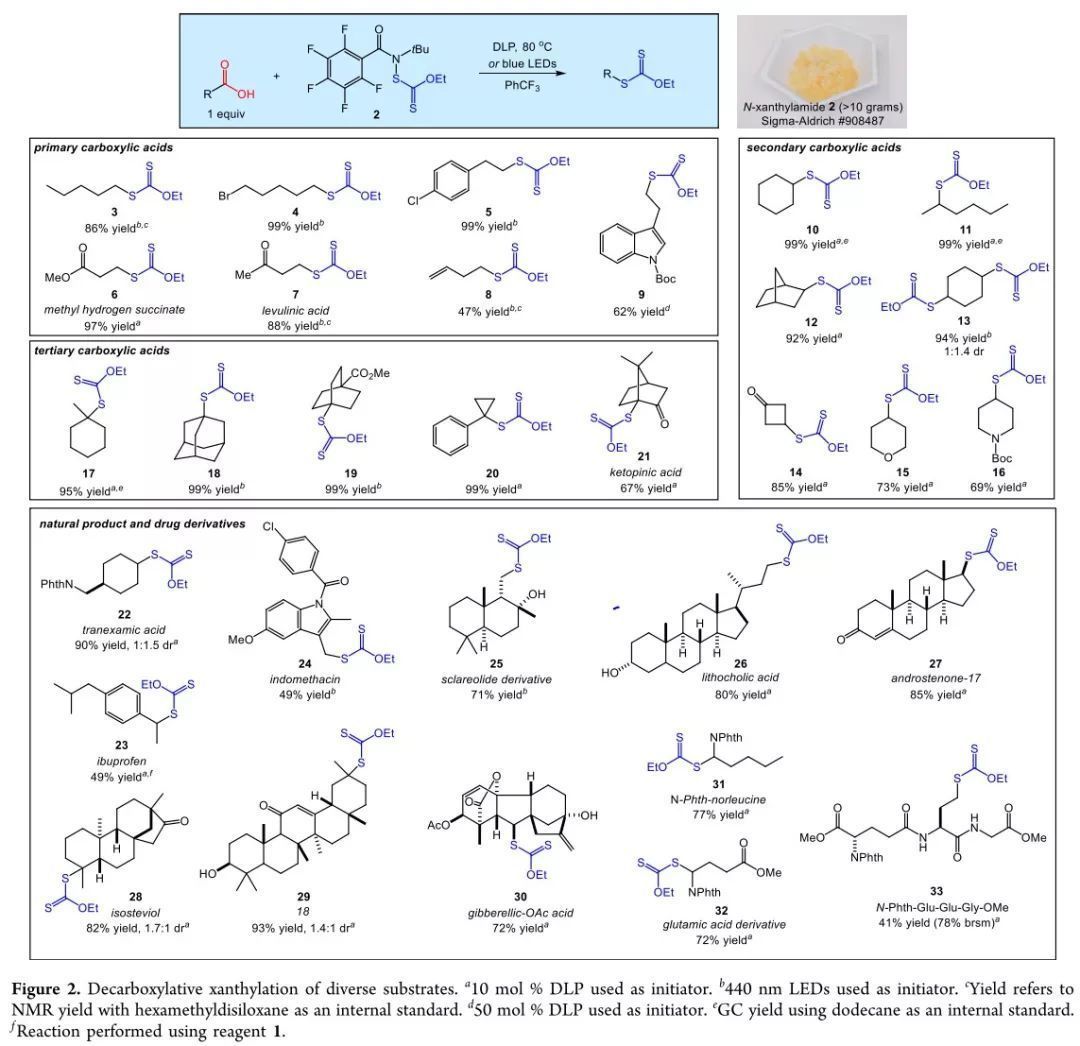
(圖片來源:J. Am. Chem. Soc.)
黃原酸酯能進一步發生多種轉化。石膽酸衍生的黃原酸酯26通過胺解以優異收率得到硫醇,隨后與葡萄糖烯丙氧苷發生光激發的Thiol-Ene反應得到偶聯產物(eq 1);赤霉素衍生的黃原酸酯可通過烷氧基胺中間體在鋅粉還原條件下發生N-O鍵斷裂生成羥基衍生物35(eq 2)。
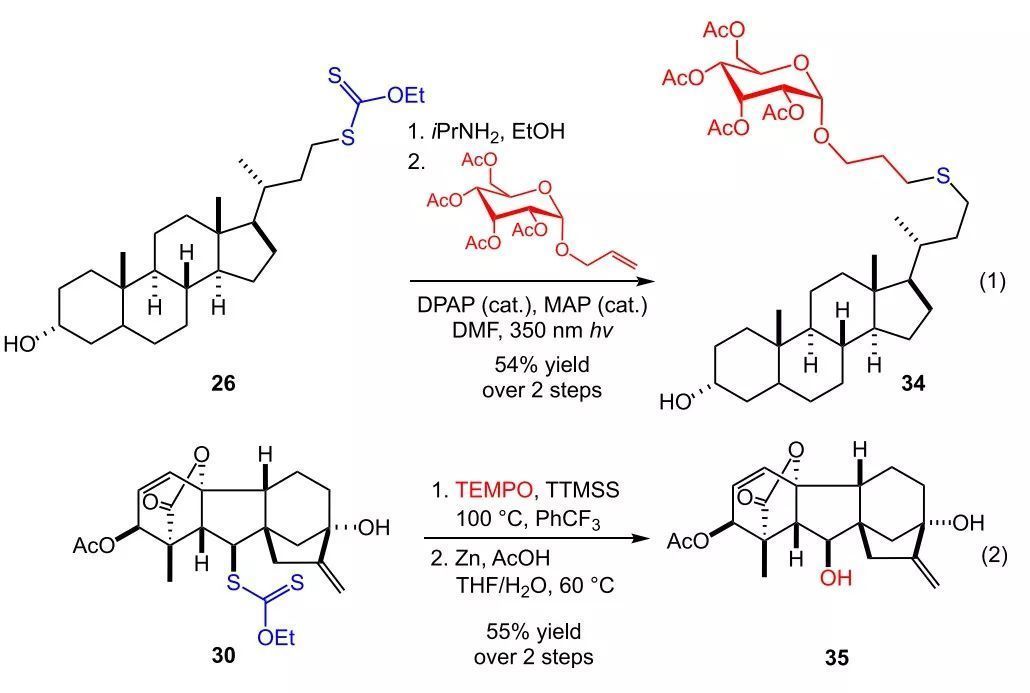
(圖片來源:J. Am. Chem. Soc.)
作者通過比較N-黃原酰酰胺和N-黃原酰磺酰胺的反應活性對O-H 鍵HAT過程進行了評估(Figure 3)。由于磺酰胺的N-H鍵BDE弱于羧基O-H鍵BDE(104 vs 112 kcal/mol),在正己酸和環己烷同時存在下,以N-黃原酰磺酰胺為HAT試劑時,僅生成環己烷C-H官能團化產物;而N-黃原酰酰胺則同時引發了環己烷的C-H活化和正己酸的自由基脫羧,證明這兩者具有不同的反應活性。因此作者分別嘗試兩種HAT試劑在金剛烷甲酸上的反應,與預期相同,N-黃原酰酰胺引發了脫羧黃原酸酯化,而N-黃原酰磺酰胺引發了C-H黃原酸酯化。
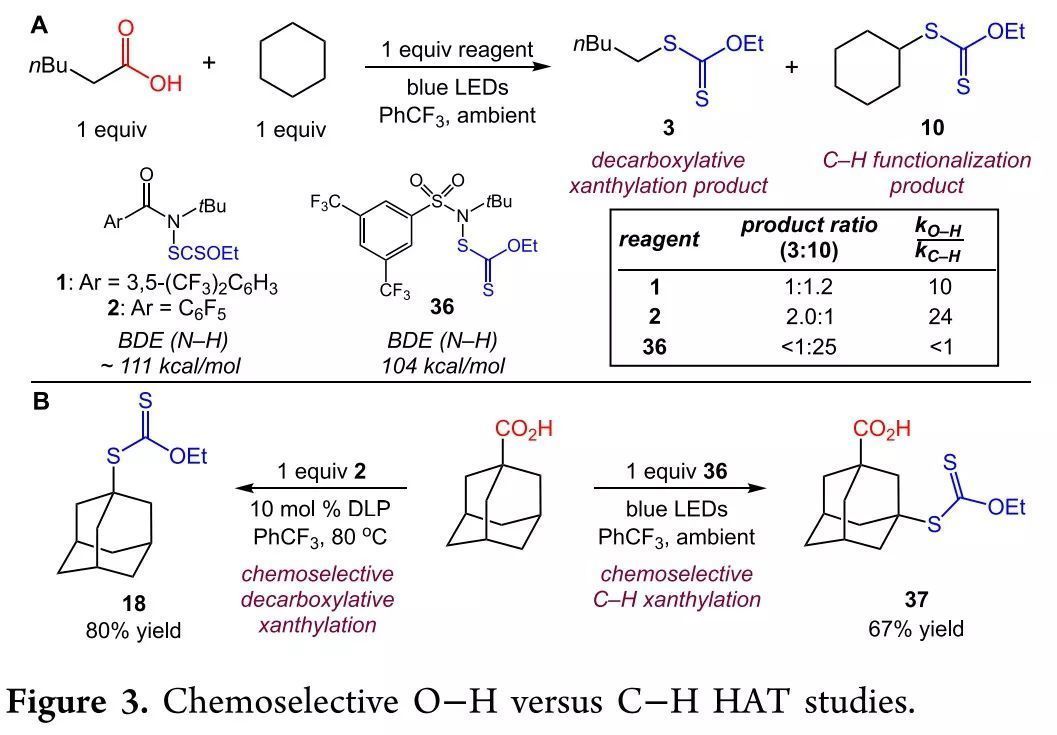
(圖片來源:J. Am. Chem. Soc.)
作者最后對機理進行了研究。作者在條件優化部分已通過羧酸鹽的反應排除了氧化自由基脫羧過程,通過黑暗中不加入自由基引發劑的實驗證明了反應的自由基歷程。作者進一步通過動力學同位素效應實驗驗證了反應經歷了在相對較弱C-H鍵存在條件下的不可逆O-H鍵HAT過程(eq 3, KIE=5.4),作者認為此化學選擇性可能源于雜原子間HAT的動力學有利性。
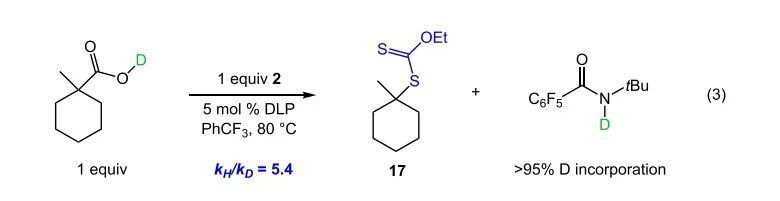
(圖片來源:J. Am. Chem. Soc.)
作者同樣通過理論計算的方式驗證了他們提出機理。在正丙酸O-H鍵HAT過程中,以五氟苯甲酰胺自由基為HAT試劑時,該過程ΔG為-1.68 kcal/mol,在熱力學上自發進行;而磺酰胺自由基進行HAT時,其ΔG變為+5.90 kcal/mol,過程無法自發進行。同時,較五氟苯甲酰胺的HAT過程,磺酰胺自由基進行HAT時需要面對更大的活化能能壘(+20.04 vs +25.39 kcal/mol)。因此,無論在熱力學上還是動力學上,五氟苯甲酰胺自由基的HAT都更加有利。
總結
北卡羅萊納大學教堂山分校Erik J. Alexanian教授課題組發展了一種基于五氟苯甲酰胺自由基HAT引發的脂肪酸脫羧黃原酸酯化反應。該反應對包括天然產物和藥物分子在內的多種羧酸均適用。產物中的黃原酸酯基團可進一步發生轉化得到后期修飾的復雜生物活性分子。作者通過對比實驗及理論計算的方法證明了五氟苯甲酰胺自由基對羧基O-H鍵的HAT過程無論在熱力學還是在動力學上都是有利的,為羧基自由基脫羧的進一步發展奠定了基礎。














