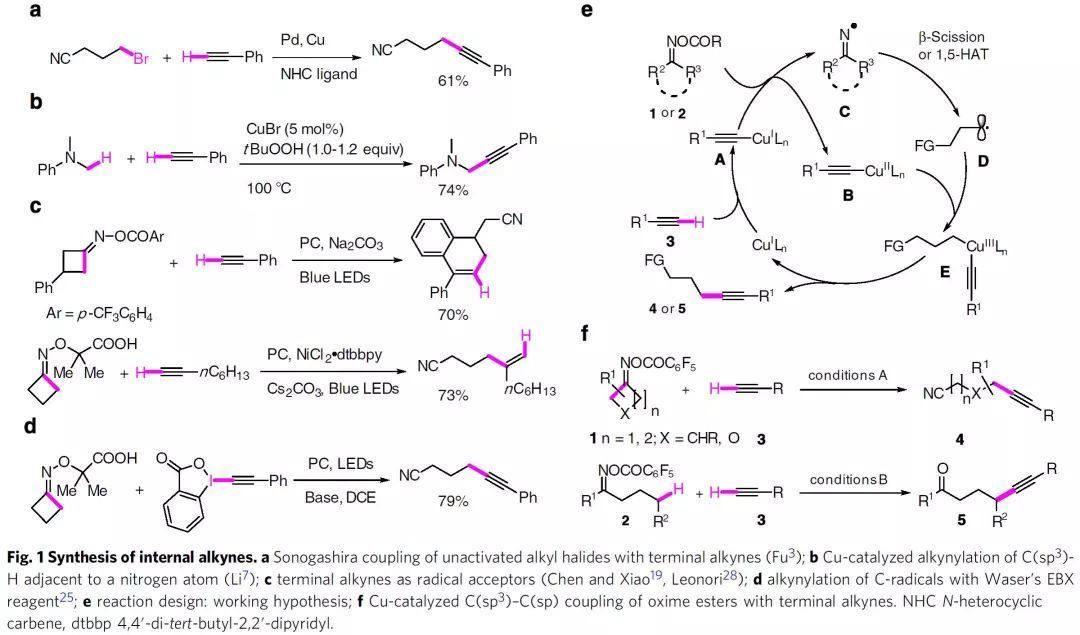
炔烴是有機合成中的重要官能團,并且存在于多種天然產物和藥物中。在眾多合成方法中,Sonogashira反應是合成內炔烴最有效的轉化之一。最初發展的在鈀/銅或銅存在下末端炔烴與芳基/乙烯基(擬)鹵化物的偶聯,也被研究人員拓展至Pd/Cu、Ni/Cu和Cu/hν催化的烷基溴化物/碘化物的反應(Fig. 1a)。另一種方法是,將N,N-二甲基苯胺衍生物原位氧化為相應的亞銨,然后與乙炔銅親核加成以合成炔丙基胺(Fig. 1b)。然而,迄今仍沒有利用末端炔烴直接進行遠程未官能化sp3碳的炔基化反應的報道。僅Waser課題組報道了光催化環烷基酮肟醚與EBX 試劑經氧化開環的炔基化反應。近日,瑞士洛桑聯邦理工學院祝介平教授課題組解決了這一挑戰,他們發展了Cu(I)鹽和三齒配體(tBu3-TERPY)催化烷酮肟酯1和2與末端炔烴3的遠程sp3碳炔基化方法,并制備了一系列多種γ-和δ-炔基腈和γ-炔基酮衍生物(Fig. 1f)。相關研究成果發表在Nat. Commun.上(DOI: 10.1038/s41467-020-14292-2)。
(來源:Nat. Commun.)
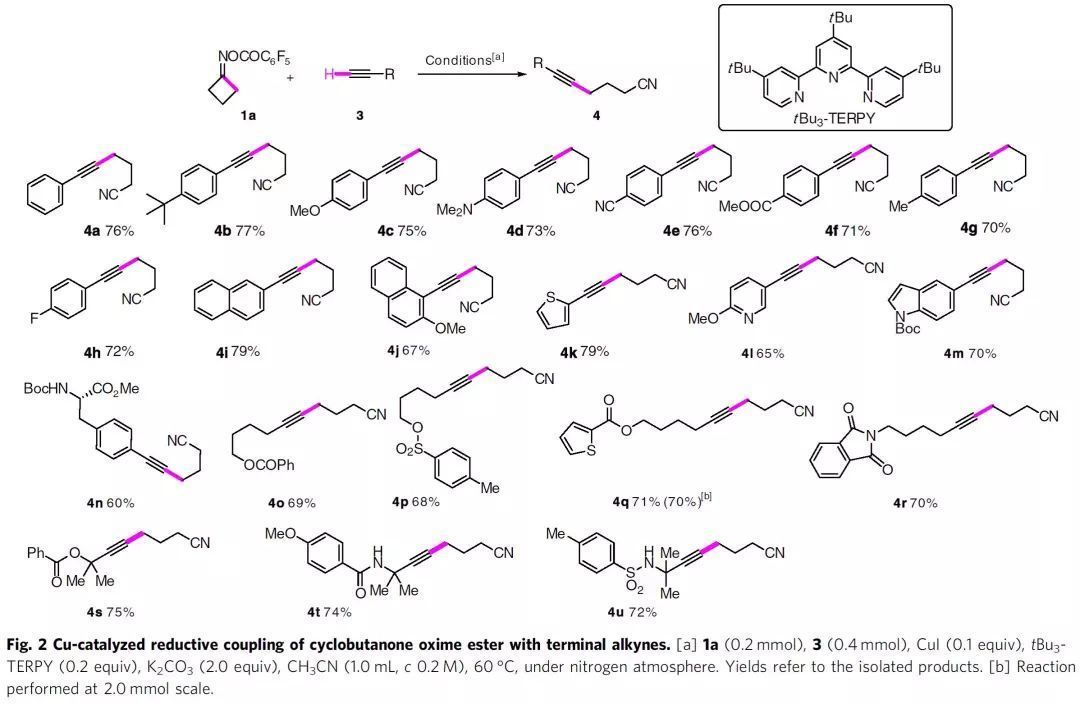
該策略的反應機制如Fig. 1e所示。由末端炔3和Cu(I)物種原位形成的乙炔銅A還原O-酰基肟1(環狀)或2(鏈狀)形成Cu(II)中間體B和亞氨自由基C。后者經β-斷裂或1,5-HAT生成碳中心自由基D,其與B發生自由基氧化加成得到Cu(III)物種E。中間體E經還原消除得到炔基化產物3,同時再生Cu(I)催化物種。研究初期,作者以環丁酮肟酯與苯乙炔3a為模型底物考察了炔基化反應的可行性。通過對酯基、銅源、配體、堿等進行系統的篩選后,作者發現反應的最佳條件為:以CuI作催化劑,tBu3-TERPY作配體,碳酸鉀作堿,1a與3a在乙腈中60 °C下反應,能以76%的收率得到目標產物4a。作者認為tBu3-TERPY作配體是反應成功的關鍵。確定最佳反應后,作者考察了底物的適用范圍(Fig. 2)。多種帶有給電子基和吸電子基的芳基或雜芳基乙炔都能以較好的收率得到γ-炔基烷基腈(4a-4u)。脂肪族炔烴也是合適的底物(4o-4w),并且兼容一系列官能團,如酯、酰胺、磺酰胺等。
(來源:Nat. Commun.)
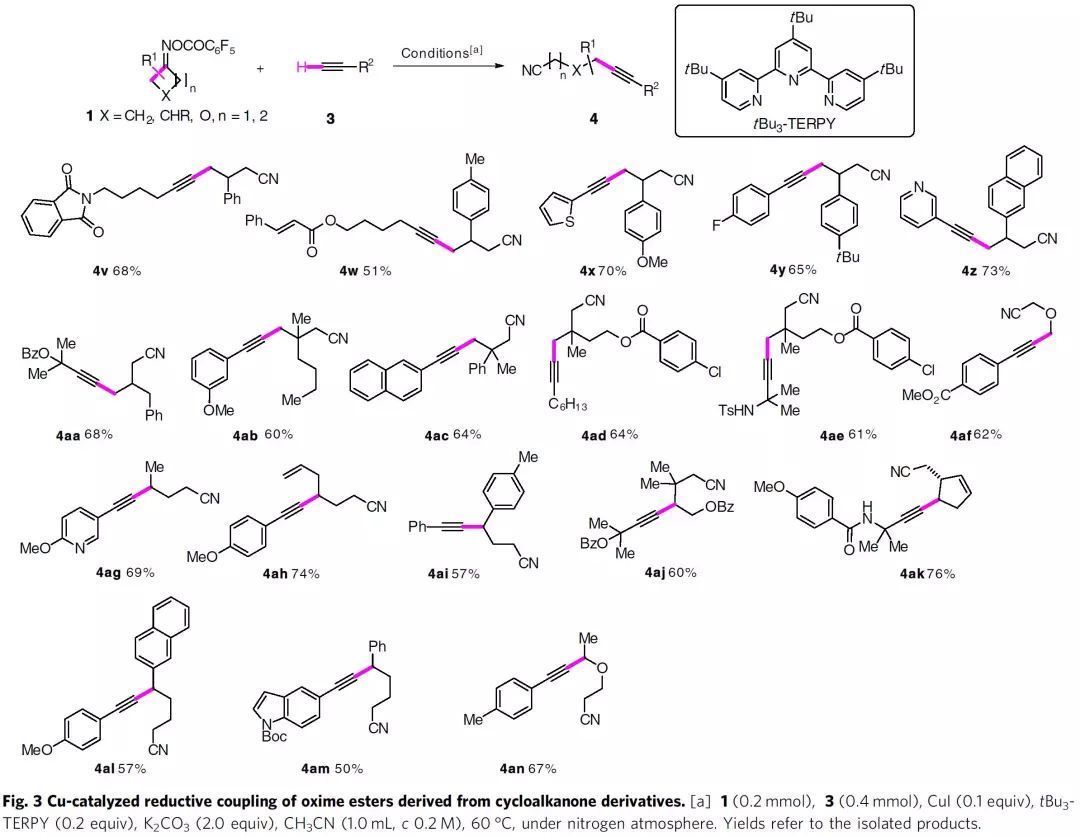
接著,作者考察了多種肟酯的適用范圍(Fig. 3)。衍生自C-3單取代或二取代的環丁酮肟酯能順利進行炔基化反應,得到相應的γ-炔基化腈(4v-4af)。C2取代的不對稱環丁酮衍生物在取代基更多的位置進行β-斷裂,并以良好的收率得到炔基化產物(4ag-4ai和4al-4am)。2,3,3-三取代肟酯1aj也適用于該反應體系。
(來源:Nat. Commun.)
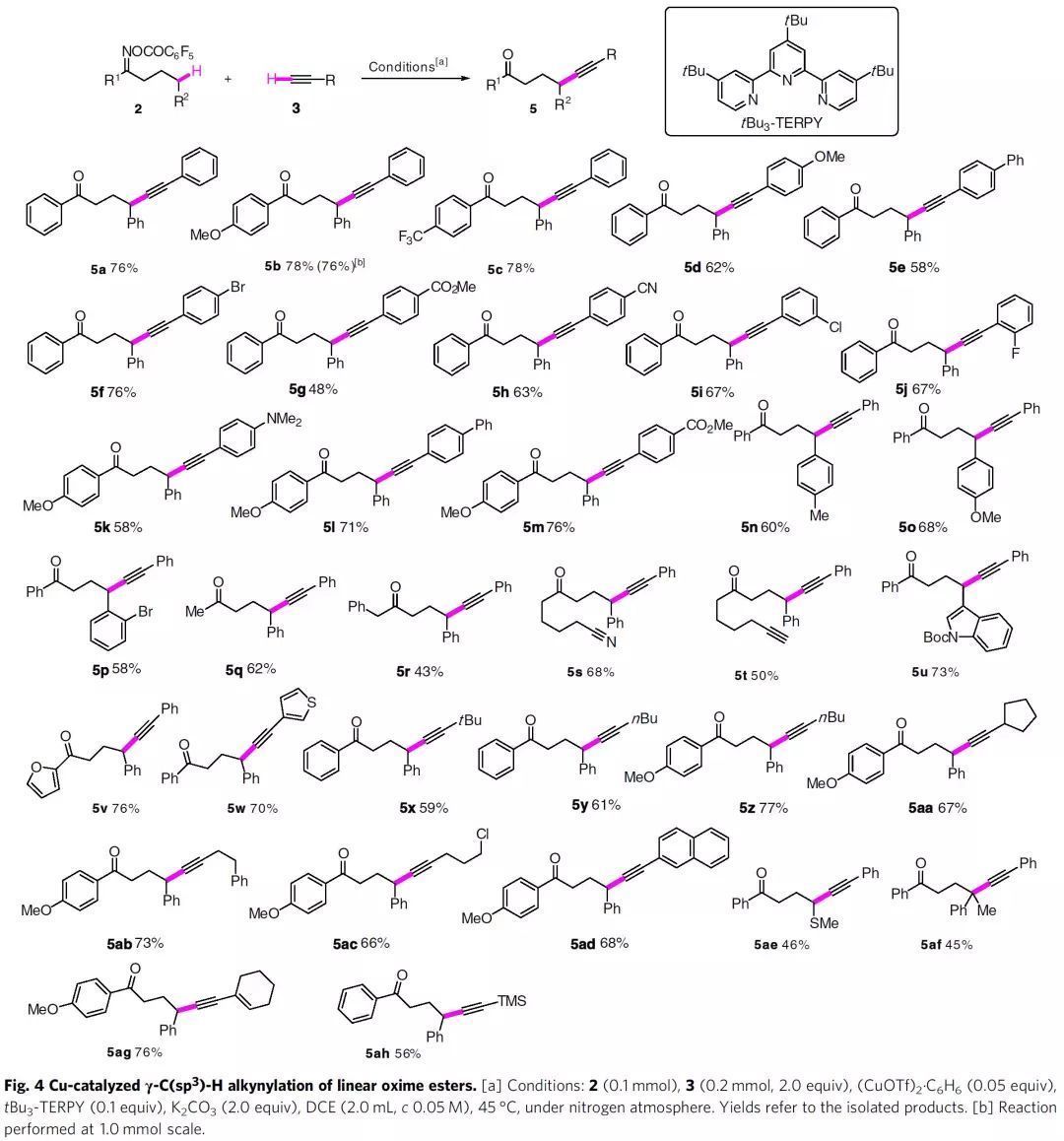
隨后,作者考察了鏈狀肟酯底物的普適性。通過對反應條件的優化,作者發現在Cu(OTf)2·C6H6和tBu3-TERPY催化下,2a和3a能以76%的收率得到內炔5a。多種不同電性的肟酯和乙炔能順利進行γ-C(sp3)-H炔基化,并以較高收率得到相應的γ-炔基酮。末端炔烴(5t)、腈基(5s)、硫醚ji(5ae)、烷基氯(5ac)和雜芳烴(5u-5w)等官能團都具有良好的耐受性。
(來源:Nat. Commun.)
綜上所述:作者發展了銅催化O-酰基肟酯和末端炔烴以合成γ-和δ-炔基腈和γ-炔基酮的高效策略。該策略經過多米諾串聯反應進行,包括亞胺基的還原生成,然后通過β-斷裂或1,5-HAT易位形成碳中心自由基,以及銅催化的C-(sp3)自由基與末端炔的偶聯。








