不對稱催化反應是高效獲得光學純化合物的最有效途徑之一。經(jīng)過半個世紀的發(fā)展,通過新催化體系的建立,已為合成工業(yè)中手性分子合成帶來了技術(shù)革新。新催化體系建立的關(guān)鍵之一是手性配體的發(fā)展和設計,利用發(fā)展的配體可以實現(xiàn)過渡金屬催化劑穩(wěn)定性、催化效率和立體選擇性的調(diào)控。設計合成新穎的手性骨架由于可以從關(guān)鍵平臺分子出發(fā),結(jié)合手性片段和雜原子手性等設計理念,衍生出不同類型的手性配體庫而受到化學家的廣泛關(guān)注。
中國科學院上海有機化學研究所金屬有機化學國家重點實驗室王鵬課題組發(fā)展了一類合成手性硅中心螺環(huán) (螺二氫苯并噻咯) 骨架的方法。利用該方法,可以構(gòu)建該手性骨架衍生的關(guān)鍵配體平臺分子 (SPSiOL),并進一步轉(zhuǎn)化得到手性硅螺環(huán)亞磷酰胺配體 (SPSiPhos) (Angew. Chem. Int. Ed., DOI: 10.1002/anie.202002289)。
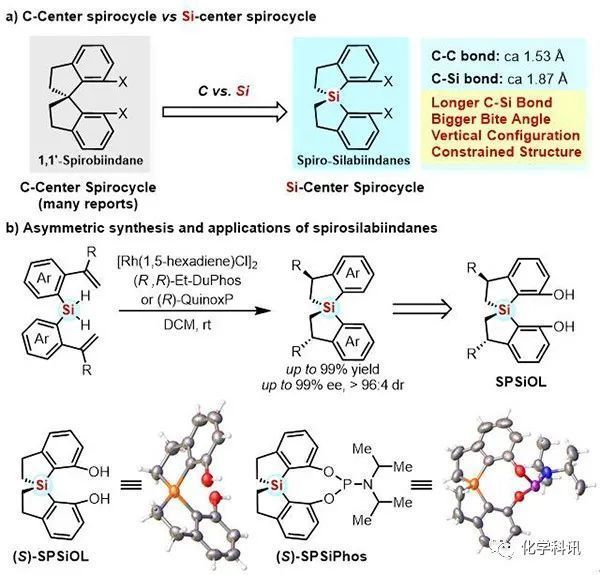
圖 手性螺二氫苯并噻咯的不對稱合成及應用
在各種手性骨架中,軸手性螺二氫茚骨架已被視為一類“優(yōu)勢手性骨架”,但是碳中心的螺環(huán)骨架合成和改造仍具挑戰(zhàn)。與碳相比,硅的原子半徑更大 (Si vs C: 111 ppm vs 67 ppm),碳硅鍵鍵長更長 (C-Si vs C-C: 1.87 埃米 vs 1.53 埃米),同時硅中心螺環(huán)接近垂直的構(gòu)像亦可能導致螺二氫苯并噻咯相較于碳中心螺二氫茚骨架更加剛性。螺二氫苯并噻咯骨架這些獨特的性質(zhì)決定了其衍生的手性催化劑或者配體可能具有與碳中心螺環(huán)衍生物不同的反應性質(zhì)和手性誘導能力,并為手性配體和催化劑開發(fā)提供新的平臺。然而,目前硅螺環(huán)骨架的不對稱合成鮮有報道 (J. Am. Chem. Soc. 1996, 118, 12469; Angew. Chem. Int. Ed. 2013, 52, 1520; J. Org. Chem. 2015, 80, 5407)。
利用Rh催化分子內(nèi)雙氫硅化反應,以 (R,R)-Et-DuPhos或 (R)-QuinoxP作為手性配體,首次實現(xiàn)了螺二氫苯并噻咯衍生物高效和高立體選擇性合成。隨后,通過該方法可以以10克級規(guī)模、優(yōu)異的收率 (90-99%)、非對映選擇性 (dr = 96:4) 和對映選擇性(ee = 99%)構(gòu)建了配體平臺分子的前體。通過X-ray單晶結(jié)構(gòu)比較發(fā)現(xiàn):硅中心螺環(huán)二酚SPSiOL與碳中心螺環(huán)二酚SPINOL相比,SPSiOL兩個苯環(huán)之間有更大的二面角 (92.2o vs 64.2o),氧氧間距離更遠 (5.155 埃米 vs 3.439 埃米)。鑒于兩者結(jié)構(gòu)上的顯著差異可能產(chǎn)生不同的反應性質(zhì)和手性誘導能力,他們從對映純SPSiOL出發(fā),進一步合成了一系列基于螺二氫苯并噻咯骨架的手性亞磷酰胺配體(SPSiPhos)。初步研究表明,SPSiPhos在Rh催化的氫化反應和Pd催化的分子內(nèi)胺芳基化反應中都展現(xiàn)出優(yōu)秀的手性誘導能力,驗證了螺二氫苯并噻咯骨架在不對稱催化中的潛力。該工作首次提出使用硅螺環(huán)作為手性骨架設計手性配體和催化劑,為進一步研究手性硅螺環(huán)結(jié)構(gòu)在不對稱催化中的應用奠定了基礎(chǔ)。
文章的第一作者為碩士研究生常鑫。上述研究工作得到了國家自然科學基金委、中國科學院和上海有機所的資助。
來源:上海有機所








