在不對稱催化領域,離子對策略得到了廣泛的應用。早在上世紀80年代,化學家就利用金雞納堿衍生的陽離子實現了相轉移催化劑的手性控制過程,隨后在這個領域,大量的研究促進了不對稱有機催化的發展(Fig. 1A, left)。在過去的幾十年里,人們采用相反的策略,即利用手性陰離子來和陽離子反應中間體配對,也取得了巨大的成功,這種策略不僅在有機催化領域得到了應用,而且在金屬催化的領域也展露鋒芒。然而,利用金屬陰離子與之配位卻研究較少。雖然有手性陽離子與金屬陰離子配位的少量研究,但大多局限于二磷雜二磷鎢酸鹽陰離子及過鉬酸鹽配合物(Fig. 1A, center)。由于金屬陰離子在大多數反應中存在較少,因此手性陽離子與過渡金屬陰離子結合的研究相對較少。鑒于手性陽離子在不對稱有機催化中良好的手性控制能力,采用一個一般性的策略實現手性陽離子與金屬催化相結合將對不對稱催化領域產生巨大影響。
在這個策略的實施過程中,Ooi課題組取得了重要的進展,他們將手性陽離子嵌入磷配體中,在鈀催化的季碳構筑反應中實現了良好的手性誘導(Fig. 1A, right)。本文設想一種更加一般性的方法,即不將手性陽離子嵌入至配體中(Fig. 1B)。手性陽離子距金屬反應中心的距離至關重要,距離太近會抑制反應進行,距離太遠則不能實現手性控制。
(掃描或長按識別圖中二維碼,識別后直達口罩購買頁面)
雖然立體選擇性的C-H去對稱化策略在鈀、銠等金屬催化的芳烴官能團化中有著廣泛應用,但直到最近才有Yu課題組實現了芳烴間位芳基化反應(Fig. 1C)。C-H硼化反應是一類極其有用的反應,C-B鍵可以實現多樣性的轉化,但是迄今為止,只有Hartwig及Ke課題組實現了芳烴硼化的手性控制。在這兩個例子中,均是利用手性配體及導向基實現芳烴鄰位的硼化反應。間位的立體選擇性硼化反應由于距離手性誘導中心較遠,在合成中仍舊是一個挑戰。
最近,英國劍橋大學的Robert J. Phipps課題組發展了陰離子聯吡啶配體,實現了銥催化的芳烴間位C-H硼化反應(Fig. 1D),反應高的間位選擇性主要是由于底物與配體中的砜基團的氫鍵作用。本文中作者設想將四丁基銨抗衡離子替換為手性陽離子,在此情況下將會產生手性環境,從而實現了立體選擇性的C-H硼化過程,通過去對稱化策略實現手性中心的構建(Fig. 1E)。相關研究成果發表在Science上(DOI: 10.1126/science.aba1120)。

(來源:Science)
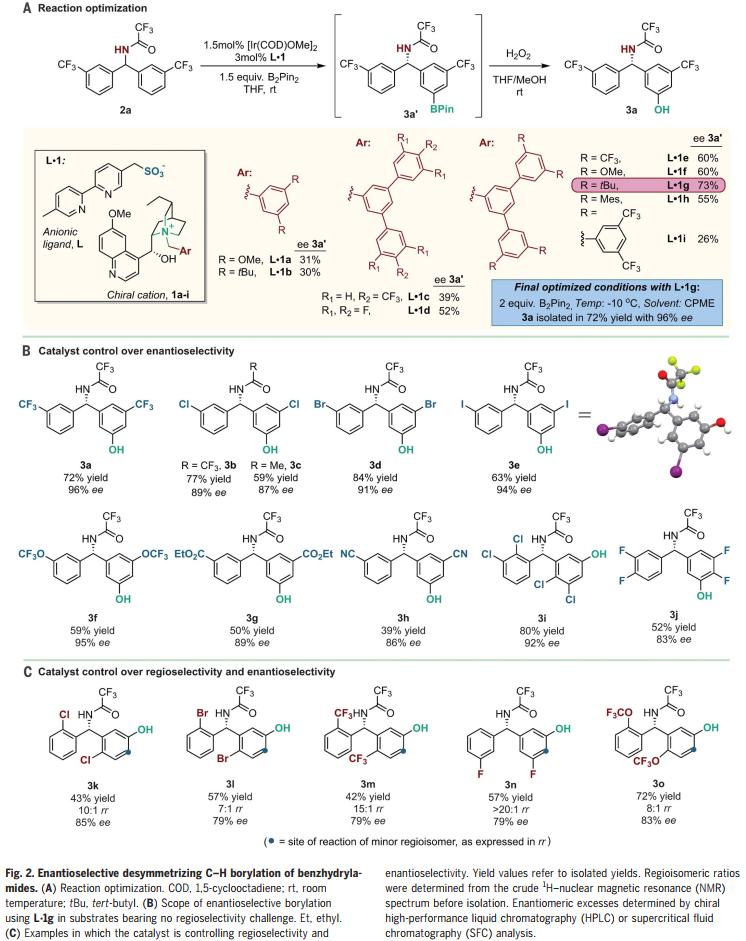
首先,作者采用苯乙酰胺2a為模板底物進行條件優化(Fig. 2A),通過對配體、溶劑與氮保護基等反應條件的優化,作者確定了反應的最優反應條件為:L.1g為手性陽離子、B2pin2為硼源、CPME為溶劑,反應于-10 ℃下反應,最終以72%的收率及96%的ee值得到目標產物。值得注意的是,反應并非動力學拆分過程。
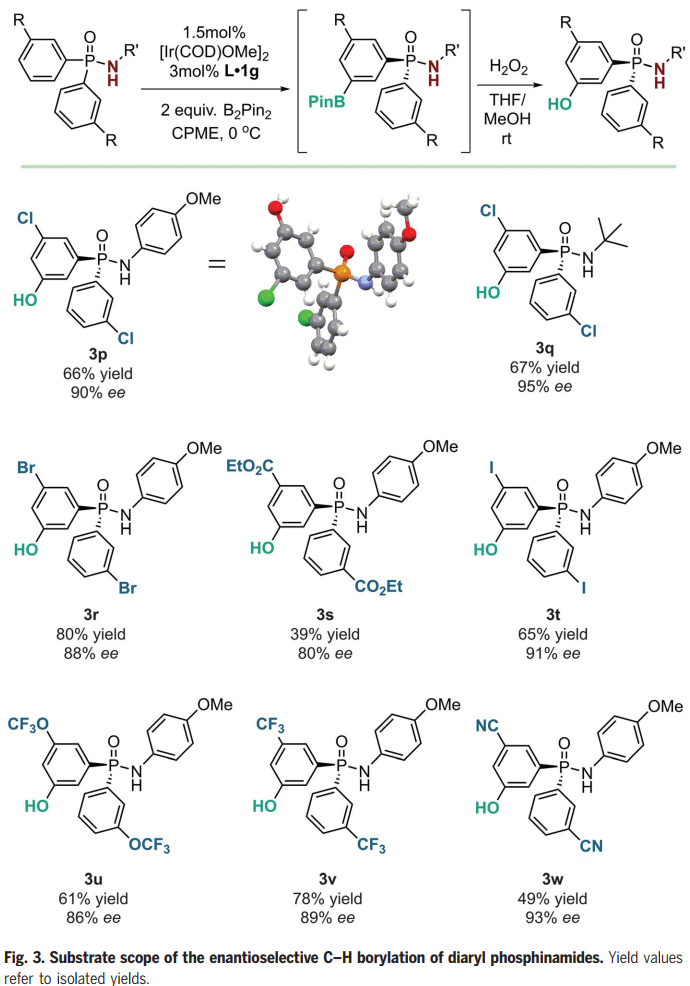
確定最優反應條件后,作者隨后對反應底物的一般性進行了考察(Fig. 2B,C)。鹵素、三氟甲氧基、酯基、硝基等基團均能兼容反應條件,將三氟乙酰基替換為乙酰基后,ee值稍有下降。供電基團取代的芳烴效果較差,可能是反應溫度太低導致的。值得注意的是,反應具有很高的間位選擇性。同時,作者發現,當底物芳烴鄰位具有鹵素取代基時,反應無需配體也可實現間位選擇性。緊接著,作者又將底物范圍擴展至對稱的磷酰胺底物(Fig. 3),反應體系也能以良好的ee值得到產物。氮上取代基可以為芳基或叔丁基,酯基、硝基等基團也不會影響反應進行。
(來源:Science)
(來源:Science)
由于使用的去對稱化策略,其中兩個官能團必須是相同的,作者設想通過此反應可以區分兩個相同官能團的差異性(Fig. 4A)。在第一個例子中,作者經間位硼化、氧化過程實現了兩個氯原子的選擇性芳基化反應;在第二個例子中,作者經間位硼化、氰化實現了兩個酯基的選擇性水解。這種差異性主要是由于新引入取代基的電性決定的。
為了說明反應的實用性,作者隨后采用配體L.1j也實現了反應的手性控制過程(Fig. 4B)。為了驗證反應中的氫鍵作用,作者N-H進行甲基化保護,所得底物并沒有反應性;反應升溫后,ee值也得到了大幅度下降,因此,底物與配體的氫鍵作用在反應性及ee值控制中均具有重要作用(Fig. 4.C)。隨后,作者將手性陽離子替換為非手性陽離子,產物消旋,說明手性陽離子與配體的離子鍵作用在手性誘導過程中至關重要(Fig. 4D)。

(來源:Science)
小結:Robert J. Phipps課題組結合手性陽離子與金屬催化劑,采用去對稱化策略,實現了芳烴間位的立體選擇性C-H硼化反應。反應設計新穎,為配體設計提供了新型的設計思路,促進了催化反應的發展。








