酮類結(jié)構(gòu)在有機合成中占有重要地位,廣泛存在于天然產(chǎn)物、藥物及材料化學(xué)中,同時,其在醇類化合物的合成及C-C成鍵研究中也有著至關(guān)重要的作用。目前,酮類化合物的合成主要依賴于:1)有機金屬試劑對醛類化合物加成,隨后氧化得到產(chǎn)物;2)有機金屬試劑與活性酯的偶聯(lián)反應(yīng)。由于羧酸相比于醛類化合物存在更加廣泛,所以第二種方法更加有用。然而,有機金屬試劑的存在使得這種方法的官能團耐受性比較低。
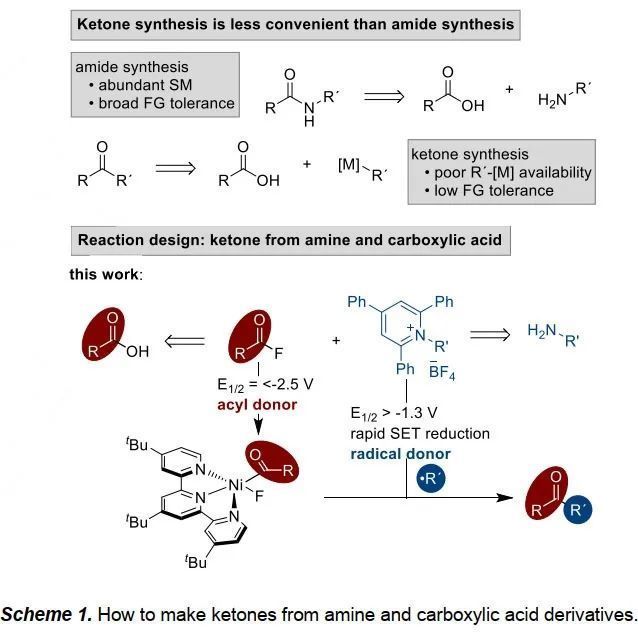
在藥物合成研究中,酰胺成鍵是一種應(yīng)用最廣泛的反應(yīng),在藥物發(fā)現(xiàn)的反應(yīng)中大約能占比25%,這主要是由于羧酸化合物簡單易得。在酮類化合物的合成中,如果能用上這類底物,將會大大增加酮類化合物的合成效率。Matsuo課題組最近報道了芳基琥珀酰胺與烷基吡啶鹽的偶聯(lián)反應(yīng),對于苯甲酸衍生的底物有著很好的效果,但對于烷基羧酸衍生的底物卻不能反應(yīng)。最近,美國威斯康星大學(xué)麥迪遜分校Daniel J. Weix課題組實現(xiàn)了兩類還原偶聯(lián)反應(yīng):1)活性酯與烷基鹵代物的偶聯(lián)反應(yīng);2)烷基吡啶鹽與芳基鹵代物的偶聯(lián)反應(yīng)。將這兩者結(jié)合,作者又實現(xiàn)了二烷基酮的合成(Scheme 1),相關(guān)研究成果發(fā)表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.202002271)。
(來源:Angew. Chem. Int. Ed.)
實現(xiàn)這個過程最主要的挑戰(zhàn)是在不增加反應(yīng)物量的情況下實現(xiàn)高選擇性的偶聯(lián)。作者設(shè)想酰基鎳中間體可與吡啶鹽衍生的烷基自由基偶聯(lián)來得到烷基酮產(chǎn)物,這就要求酰基底物可以與鎳催化劑快速地氧化加成。同時,此中間體還不能被輕易地還原為自由基。最后作者將目光鎖定在酰基氟底物。酰基氟具有以下優(yōu)勢:1)可原位生成或可以分離得到;2)游離的氟原子不會對催化劑有影響。
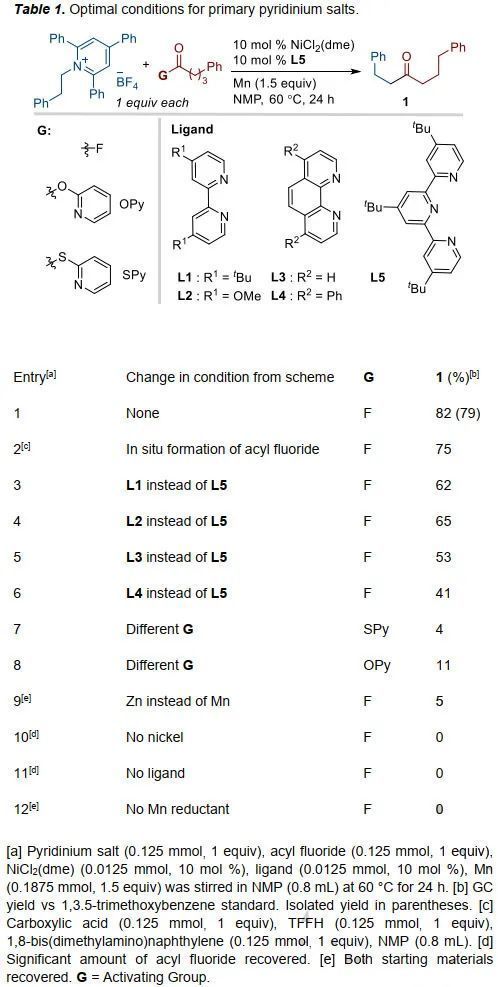
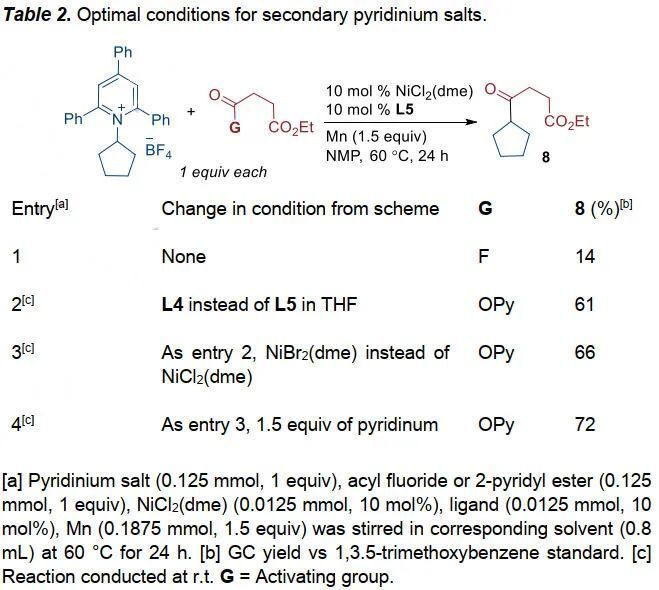
首先,作者采用酰基氟與一級烷基吡啶鹽為模板底物進行條件優(yōu)化(Table 1),通過對配體、溶劑、添加物及反應(yīng)溫度的優(yōu)化,作者確定了最優(yōu)條件為:NiCl2(dme)為金屬催化劑、L5為配體、Mn為還原劑、NMP為溶劑,反應(yīng)于60 oC下反應(yīng)24 h,最終可以79%的分離收率得到目標(biāo)產(chǎn)物。針對二級烷基吡啶鹽,作者又重新對反應(yīng)條件進行了篩選(Table 2),主要改變?yōu)椋?)酰基氟底物替換為2-吡啶酯底物;2)溶劑換為THF;3)催化體系修改為NiBr2(dme)/L4體系;4)稍微增加吡啶鹽的比例。
(來源:Angew. Chem. Int. Ed.)
(來源:Angew. Chem. Int. Ed.)
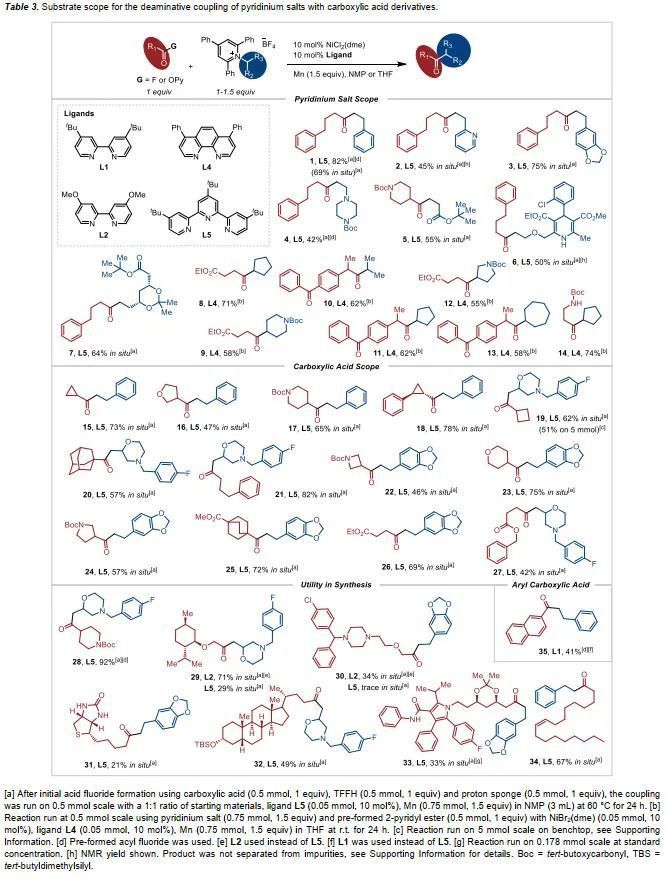
確定最優(yōu)條件后,作者隨后對反應(yīng)的底物范圍進行了擴展(Table 3),直鏈及α-支鏈的吡啶鹽均能很好地參與反應(yīng),但是三級胺衍生的吡啶鹽不能有效得到產(chǎn)物。一級、二級及三級羧酸均能以高收率得到產(chǎn)物,但是位阻更大的三級羧酸收率較低。α-烷氧基羧酸這類底物存在于活性分子結(jié)構(gòu)中,也可以中等收率得到相應(yīng)酮類化合物。反應(yīng)體系具有良好的官能團耐受性,胺、吡啶、烯烴等結(jié)構(gòu)均能兼容反應(yīng)條件。值得一提的是,N-H鍵、脲類結(jié)構(gòu)及酯、酮結(jié)構(gòu)也能很好地兼容反應(yīng),這在有機金屬試劑參與的方法中是很難實現(xiàn)的。
(來源:Angew. Chem. Int. Ed.)
最后,作者針對反應(yīng)機理進行了說明:1)首先零價鎳對酰基氟進行氧化加成得到二價鎳中間體;2)吡啶鹽生成的烷基自由基被二價鎳中間體捕獲,生成三價鎳中間體;3)中間體還原消除得到最終產(chǎn)物。此外,作者并不能排除一價鎳的催化機理。
小結(jié):Daniel J. Weix課題組利用簡單易得的羧酸及胺衍生的吡啶鹽底物,實現(xiàn)了二烷基酮的合成,反應(yīng)原料價廉易得,為烷基酮的合成提供了新型的方法,同時也為藥物化學(xué)家提供了新型的合成工具。








