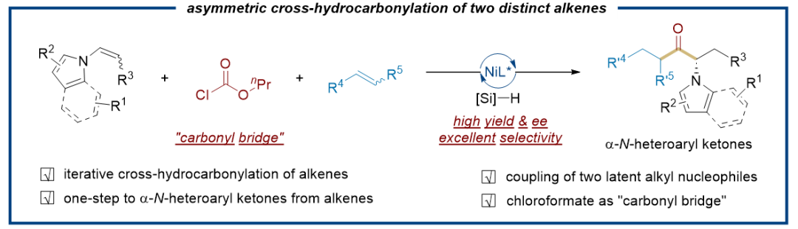
手性α-氨基酮既是生物活性分子及天然產物中常見的結構片段,也是一種合成氨基醇和氮雜環等其他高價值結構的中間體。手性α-氨基酮的傳統合成方法主要依賴從預制備的復雜前體出發通過多步合成制備。催化條件下,從簡單易得的原料出發直接高效構建手性α-氨基酮存在巨大挑戰。另外,烯烴是最豐富和易得的大宗化學品之一,廣泛應用于各種官能團和功能性分子的合成。其中,鎳催化烯烴的氫金屬化可以催化生成烷基金屬物種。近日,南方科技大學化學系舒偉教授團隊在前期金屬催化烯烴-烯烴不對稱交叉偶聯的研究基礎上,發展了鎳催化非活化烯烴和N-烯基雜芳烴在氧化還原中性條件下的化學選擇性、區域選擇性和對映選擇性羰基化反應。該策略從兩種烯烴出發,無需使用當量烷基親電試劑,也無需使用當量烷基親核試劑,實現了溫和條件下α-N-雜芳基酮的高效不對稱合成。該反應無需使用有毒氣體的一氧化碳氣體。氯甲酸酯既作為羰基來源,也作為平衡反應氧化還原的電子受體。
在最優條件下,作者對N-烯基雜芳烴和非活化烯烴的適用范圍進行了考察。結果表明,在N-烯基吲哚的3、4、5、6及7號位引入給電子或者拉電子基團,反應均能很好地進行。其它含氮雜環,如咔唑,四氫咔唑及吡咯等,也能很好地在反應中兼容。此外,非末端N-烯基吲哚也可以很好發生反應。帶有鹵素、硫醚、酰基、氰基、羥基以及氨基等官能團的末端非活化烯烴均能很好地適用于該反應。1,1-二取代烯烴、環狀烯烴以及1,2-二取代非活化烯烴也能夠在反應中很好的兼容。初步機理研究表明,鎳氫優先對非活化烯烴發生氫金屬化,且該過程是可逆的。最終,酰基鎳氫中間體選擇性對N-烯基雜芳烴進行遷移插入。 綜上所述,舒偉課題組首次開發了一種鎳催化非活化烯烴與N-烯基雜芳烴的交叉氫羰基化反應直接制備手性α-N-雜芳基酮的方法。該反應使用非活化烯烴作為一級烷基金屬物種替代物,N-烯基雜芳烴作為二級烷基金屬物種前體,氯甲酸酯作為一氧化碳的替代物和電子受體,化學、區域和對映選擇性將兩種烯烴以及氯甲酸酯組裝在一起。該反應為手性α-氨基酮的高效合成提供了一種切實可行的高效替代方法。 論文信息 Synthesis of α-N-Heteroaryl Ketones by Nickel-Catalyzed Chemo-, Regio- and Enantioselective Carbonylation of Alkenes and N-Alkenyl Heteroarenes Xiao-Yi Chen, Dr. Qiong Yu, Prof.?Dr. Wei Shu Angewandte Chemie International Edition DOI: 10.1002/anie.202423426