倍半萜醌及氫醌類天然產(chǎn)物因其廣泛的生物活性和結(jié)構(gòu)復(fù)雜性,在有機(jī)合成領(lǐng)域具有重要研究?jī)r(jià)值。其中,從海綿Dysidea中分離得到的cycloaurenones和dysiherbols尤為引人注目。這兩類化合物雖然共享6/6/5/6四環(huán)骨架的核心結(jié)構(gòu)特征,卻在立體化學(xué)構(gòu)型上表現(xiàn)出明顯差異:cycloaurenones具有順式十氫萘環(huán)結(jié)構(gòu),而dysiherbols則呈現(xiàn)反式十氫萘構(gòu)型。Cycloaurenones因其順式并環(huán)和連續(xù)季碳中心的立體選擇性構(gòu)建難題,至今尚未實(shí)現(xiàn)全合成;而已知關(guān)于的dysiherbols的合成方法則依賴于特定起始原料,在合成效率及路線發(fā)散性方面存在局限。
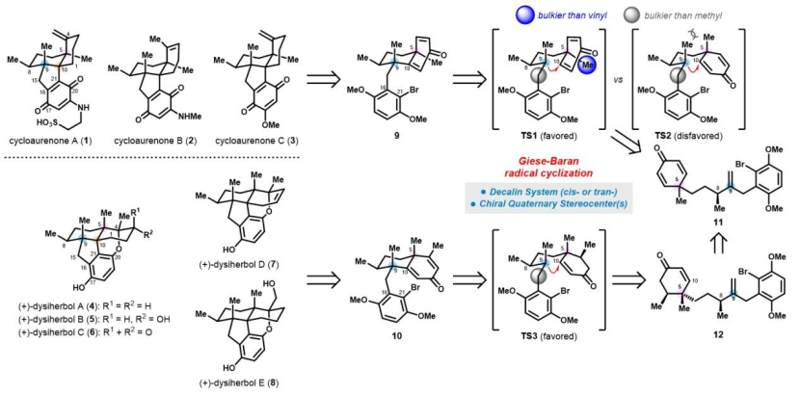
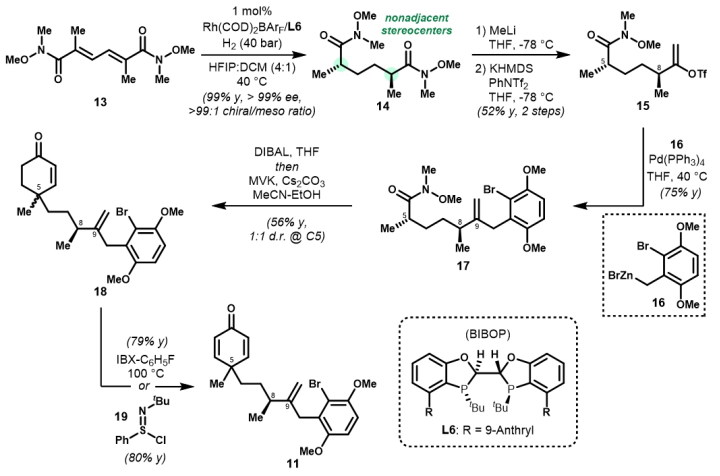
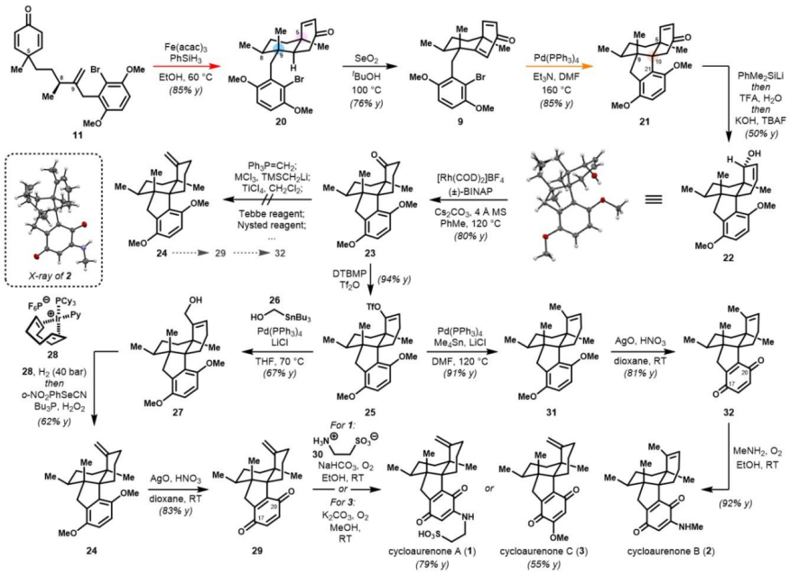
鑒于這兩類天然產(chǎn)物在結(jié)構(gòu)和生源合成上的高度相似性,西湖大學(xué)陸海華教授團(tuán)隊(duì)基于通用環(huán)己二烯酮中間體的新型區(qū)域去對(duì)稱化反應(yīng),即鐵催化的分子內(nèi)自由基環(huán)化及銅催化的對(duì)映選擇性共軛加成,首次實(shí)現(xiàn)了cycloaurenones和dysiherbols的對(duì)映選擇性發(fā)散全合成。 研究團(tuán)隊(duì)首先通過(guò)對(duì)共軛二烯型Weinreb二酰胺13的高效不對(duì)稱氫化,以優(yōu)異的立體選擇性(> 99:1 d.r., > 99% e.e.)構(gòu)建了1,4-非連續(xù)手性中心,得到了14。隨后,利用雙向合成策略,即14的酰基親核單取代甲基化、隨后經(jīng)Negishi偶聯(lián)、Robinson環(huán)化等關(guān)鍵步驟,快速制備了通用環(huán)己二烯酮中間體11。 針對(duì)cycloaurenones的合成,團(tuán)隊(duì)創(chuàng)新性地采用區(qū)域去對(duì)稱化的Giese–Baran型自由基環(huán)化反應(yīng),以出色的非對(duì)映選擇性同時(shí)構(gòu)建了C5和C9位的全碳季碳中心。后續(xù)通過(guò)Pd催化的還原Heck反應(yīng)、酸介導(dǎo)的羥基移位反應(yīng)及Rh催化的烯丙醇異構(gòu)等策略,構(gòu)建了cycloaurenones的稠合四環(huán)骨架,并通過(guò)苯醌的后期官能團(tuán)化,最終完成了(+)-cycloaurenones A?C的首次全合成。 在dysiherbols的合成中,研究人員則利用從通用中間體11的銅催化不對(duì)稱共軛加成構(gòu)建C5季碳中心,隨后通過(guò)Giese–Baran型自由基環(huán)化反應(yīng)、分子內(nèi)共軛加成環(huán)化、烯丙醇脫水的烯丙位取代等策略,實(shí)現(xiàn)了(+)-dysiherbols A和D的全合成以及(+)-dysiherbols B、C和E的形式全合成。 該工作首次實(shí)現(xiàn)了天然產(chǎn)物cycloaurenones和dysiherbols的首次對(duì)映選擇性發(fā)散全合成。所建立的關(guān)鍵合成方法——包括不對(duì)稱氫化、區(qū)域去對(duì)稱化的自由基環(huán)化和不對(duì)稱共軛加成等——為復(fù)雜天然產(chǎn)物的合成提供了新范式,也為后續(xù)生物活性研究和藥物開(kāi)發(fā)奠定了重要基礎(chǔ)。 論文信息 Enantioselective Divergent Total Syntheses of Cycloaurenones and Dysiherbols Yu-Hao Huang, Qing-Xiu Gu, Qing-Cen Chao, Han-Zhi Xiao, Hai-Hua Lu Angewandte Chemie International Edition DOI: 10.1002/anie.202507638