分享一篇發表在JACS上的文章,題目為“A Chemoproteomic Approach for System-Wide and Site-Specific Uncovering of Functional Protein N-Glycosylation”。文章的通訊作者是復旦大學的張瑩研究員和陸豪杰教授,他們的研究興趣都集中在翻譯后修飾的質譜分析方法。

熱蛋白質組學(TPP)技術將細胞熱位移分析(CETSA)與多重定量質譜分析相結合,允許了蛋白質熱穩定性的全局變化解析,并助力了很多內源相互作用的發現。然而,標準的TPP流程依賴于通過多個通道、多個溫度點的定量結果擬合求算溶解溫度變化(ΔTm),容易因采樣不足而遺漏低豐度蛋白或低化學計量的修飾;此外,這種逐個定量也使得整個TPP流程在操作上較為復雜。為了克服上述缺點,Zubarev等人在2019年提出了一種稱為蛋白質組積分溶解度改變(PISA)的替代方案( J Proteome Res. 2019; 18(11): 4027-37),該方法跳過了經典TPP流程中的逐個溫度點定量,而是將溶解溫度范圍內的所有溫度點合并定量,通過計算擬合對應的曲線下面積(Sm)。這一方法極大地簡化了TPP的實驗操作,部分地解決了上述問題。
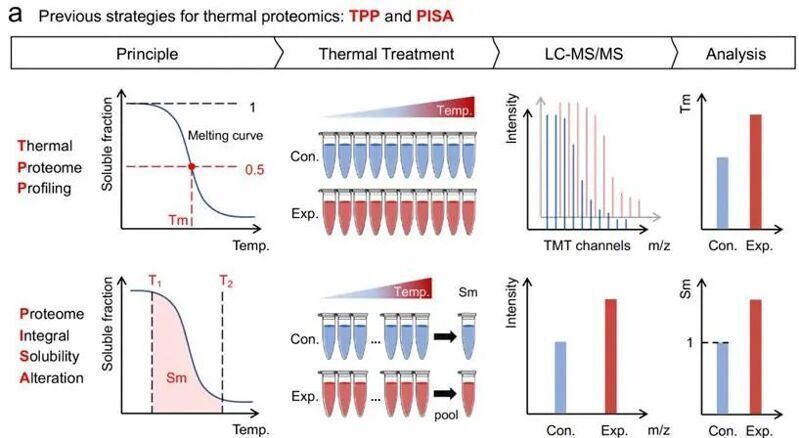
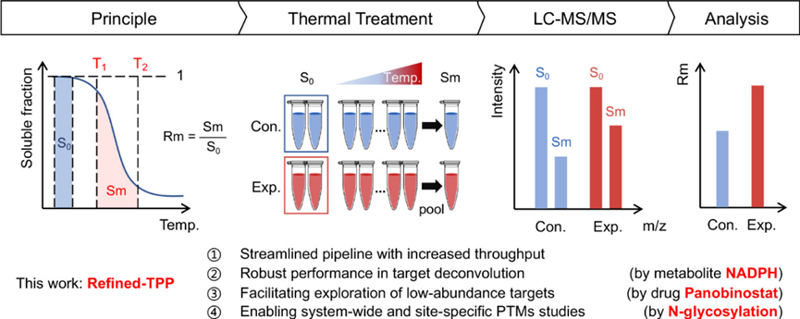
但隨著PISA的應用,人們發現ΔSm與ΔTm之間的線性關系不夠良好,尤其是在ΔTm值較大的情況下。在本文中,作者提出了一種進一步的改進方案,稱為Refined-TPP。該方法在低溫和高溫兩個范圍內定量曲線下面積,以面積比Rm = Sm/S0實現歸一化校正。作者在公共的TPP數據集上進行了基準測試,證明了與PISA相比,Refined-TPP方法能更真實地反映實際的ΔTm值。
隨后,作者將該方法應用于已知的HDAC抑制劑 panobinostat的藥物靶標分析。結果顯示,與傳統TPP方法相比,Refined-TPP方法能鑒定到額外的 1016 種潛在靶標。對于已知靶標HDAC6,ΔRm與ΔTm的鑒定結果高度吻合。值得注意的是,Refined-TPP方法也能鑒定到一些被傳統TPP方法遺漏的靶標,例如HDAC1,其具有非典型S形的熔解曲線,從而被TPP鑒定所遺漏,但在Refined-TPP鑒定中可被找回。

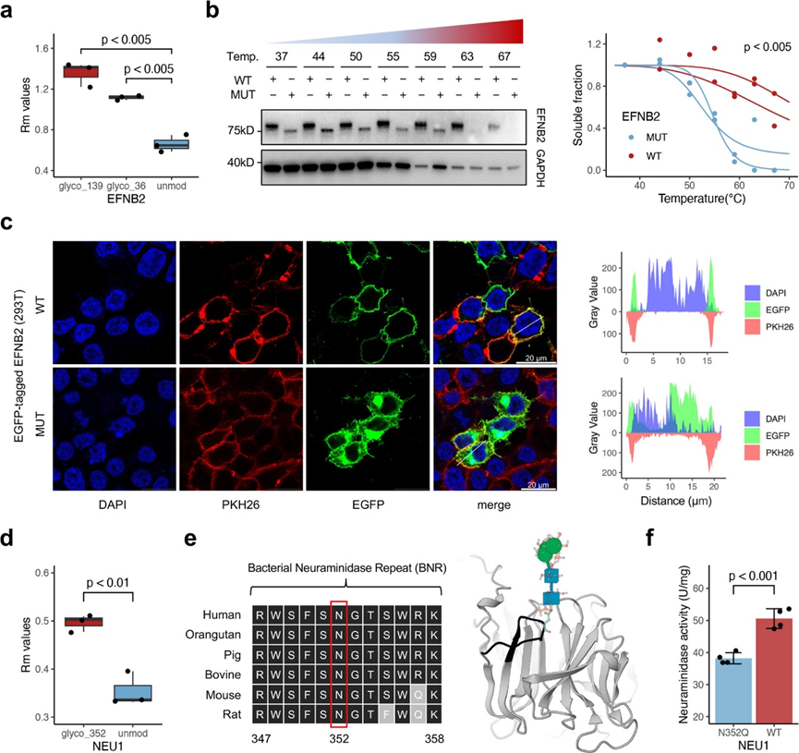
進一步地,作者將該方法應用于糖基化修飾的研究。作者提出了一種稱為糖依賴性熱轉移分析 (GTSP)的策略,即將細胞裂解物按Refined-TPP流程制樣后,分別定量全蛋白質組或其中富集的糖蛋白,對于每種蛋白求算兩種組分之間的ΔRm。在這種策略下,預期那些具有功能的糖基化修飾將引起Rm的顯著變化。結果顯示,糖基化修飾的蛋白整體上具有更高的Rm,尤其是 113 個蛋白質的 208 個位點上的 N-糖基化顯著地提高了蛋白的熱穩定性,暗示這些糖基化修飾可能具有關鍵功能。作者成功驗證了其中一些糖基化修飾的功能,如EFNB2 N36 和 N139 上的N-糖基化穩定了蛋白結構,且改變了蛋白的細胞定位。又例如,NEU1 N352 上的 N-糖基化穩定了其結構,同時對其維持酶活性具有關鍵作用。
總結而言,本文改進了TPP和PISA方法,提出了Refined-TPP,并利用該方法成功實現了更優的化合物靶標鑒定和功能糖基化修飾的發現。
本文作者:TYC
責任編輯:WYQ
DOI:10.1021/jacs.5c08065
原文鏈接:https://doi.org/10.1021/jacs.5c08065








