推薦一篇發表在Angewandte Chemie International Edition上的文章,其標題為“A Genetically Encoded Homocysteine Precursor to Probe Protein Active Sites and to Addict Escherichia coli to a Noncanonical Amino Acid Directly Involved in Catalysis”。本文通訊作者是來自德國明斯特大學生物化學研究所的Henning D. Mootz教授,其課題組致力于通過化學和基因工程學的策略,為目的蛋白賦予新的生物學功能。本文中,作者設計并合成了化學基團保護的非天然氨基酸高半胱氨酸,并通過遺傳密碼子拓展技術插入到目的蛋白的關鍵殘基上,最終實現目的蛋白的可控激活。

高半胱氨酸(homocysteine)由于其優秀的反應性,兩親性以及較小的尺寸,而廣受蛋白質結構功能相關研究者的關注。此前研究中,通過蛋白質半合成等方式引入的高半胱氨酸往往由于無法復刻天然蛋白結構,而不能有效展現其生物學效應。而通過遺傳密碼子拓展技術引入的Photo-高半胱氨酸在極大地保留天然蛋白結構的同時,可通過紫外脫保護實現蛋白活性的有效調控。然而,因受到紫外光毒性的影響,Photo-高半胱氨酸的應用難以普及。
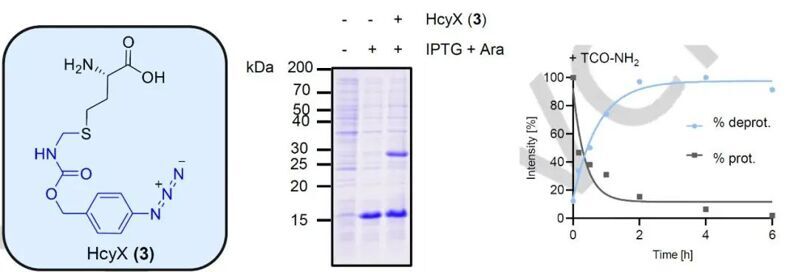
為了解決這一問題,本文中,作者創新地在高半胱氨酸的側鏈上引入了PAB為核心的保護基團,設計出了HcyX。HcyX可以通過TCEP進行化學脫除,或者通過TCO基團進行生物正交脫除,避免了光毒性的問題。隨后,為了通過遺傳密碼子拓展技術將HcyX引入到目的蛋白,研究者以GFPN149TAG為靶蛋白,進行了合成酶的篩選。由此,他們得到了具有L309A, C348A, 和Y384F突變的M. barkeri 吡咯賴氨酰-tRNA合成酶。后續,他們通過引入P188G突變進一步增強了該合成酶的穩定性。
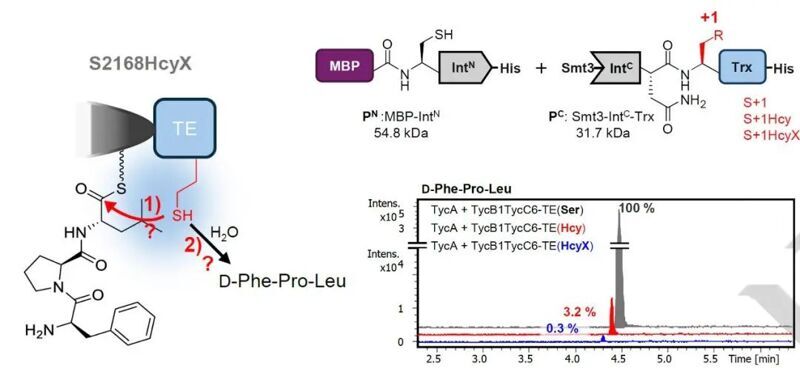
通過變性凝膠電泳以及ESI-MS一級質譜的檢測,研究者確定了HcyX探針成功地插入到了目的蛋白中,并且可以有效地進行保護基團的脫除,最終實現了在特定位點的高半胱氨酸的引入。隨后,研究者分別在包括TEV酶,硫酯酶和Inteins等蛋白上進行了高半胱氨酸的插入與活性激活。結果顯示,除了TEV酶外,其它蛋白的活性都可以有效地被HcyX抑制,并在保護基團脫除后恢復一定的活性。
綜上,本文中,作者設計并構建了可通過遺傳密碼子擴展技術定點插入的非天然氨基酸HcyX,實現了高半胱氨酸引入的同時,還可對目的蛋白的活性進行調控。本研究對于蛋白功能的衍生化,以及蛋白工程化研究來說,具有重要的意義。
本文作者:KLH
責任編輯:LZ
DOI:10.1002/anie.202509112
原文鏈接:https://doi.org/10.1002/anie.202509112








