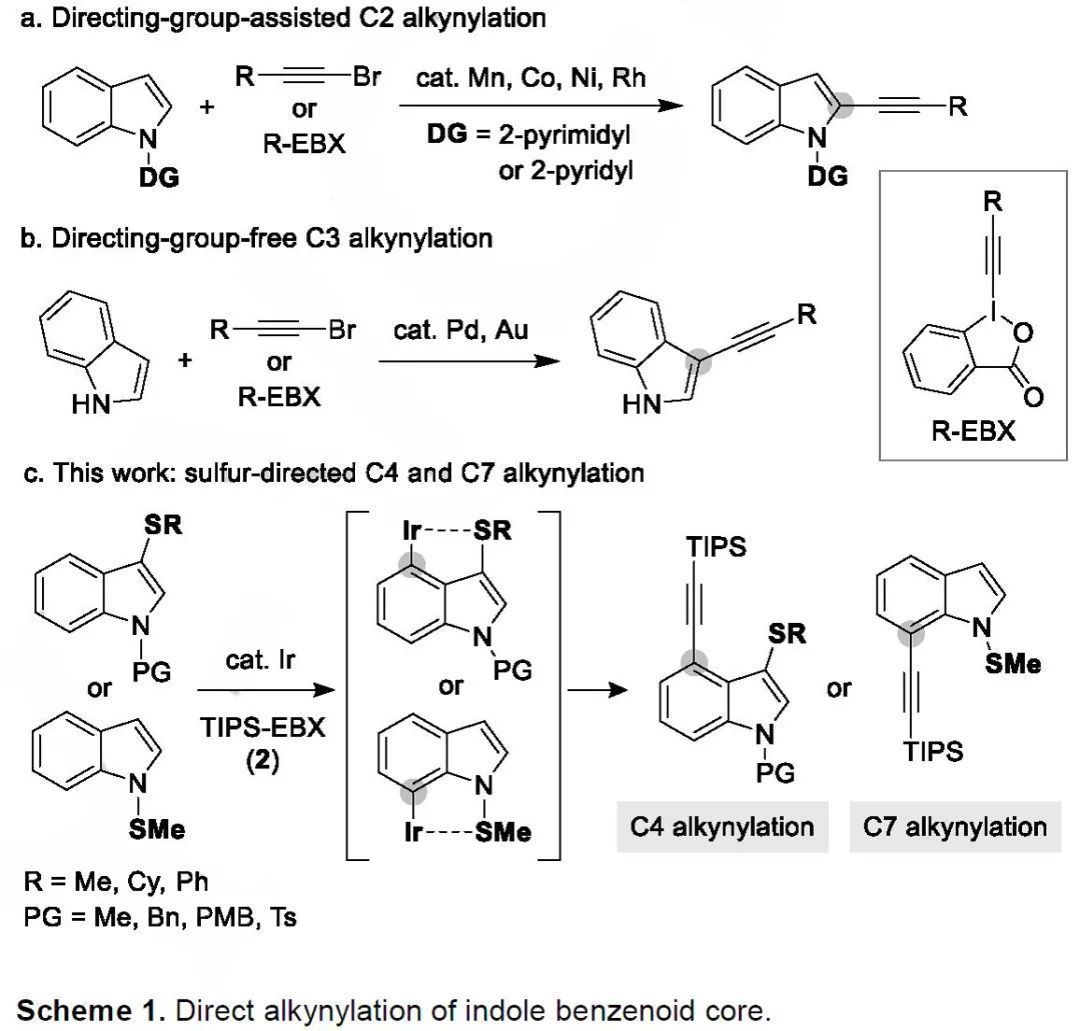
吲哚雜芳族骨架由于其廣泛存在于多種市售藥物、生物活性化合物和功能分子中而被為是優(yōu)勢(shì)雜環(huán)化合物之一。因此,科研人員對(duì)吲哚衍生物的位點(diǎn)選擇性修飾非常感興趣,近年來,過渡金屬催化的C-H鍵直接轉(zhuǎn)化也已成為后期官能化的重要合成工具。吲哚核心上含有六個(gè)獨(dú)特的反應(yīng)位點(diǎn),然而,在吲哚的苯環(huán)片段而不是在高反應(yīng)性C2和C3位置上選擇性的官能化仍充滿挑戰(zhàn)。為解決上述難題,近年來,在導(dǎo)向基的作用下,研究人員已經(jīng)發(fā)展了多種包括烷基化、烯基化、芳基化、胺化和硼酸化的催化方法(Scheme 1a)。盡管研究人員利用溴炔烴或ethynylbenziodoxoles(TIPS-EBX)為炔基化試劑,已經(jīng)開發(fā)出C2和C3位官能化的催化體系(Scheme 1b),但是仍沒有苯環(huán)核心上發(fā)生炔基化的報(bào)道。近日,日本大阪大學(xué)Masahiro Miura教授課題組在硫?qū)蚧鶊F(tuán)的作用下首次實(shí)現(xiàn)了銥催化吲哚C4和C7位上的直接炔基化反應(yīng)。相關(guān)研究成果發(fā)表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.201904709)。
(來源:Angew. Chem. Int. Ed.)
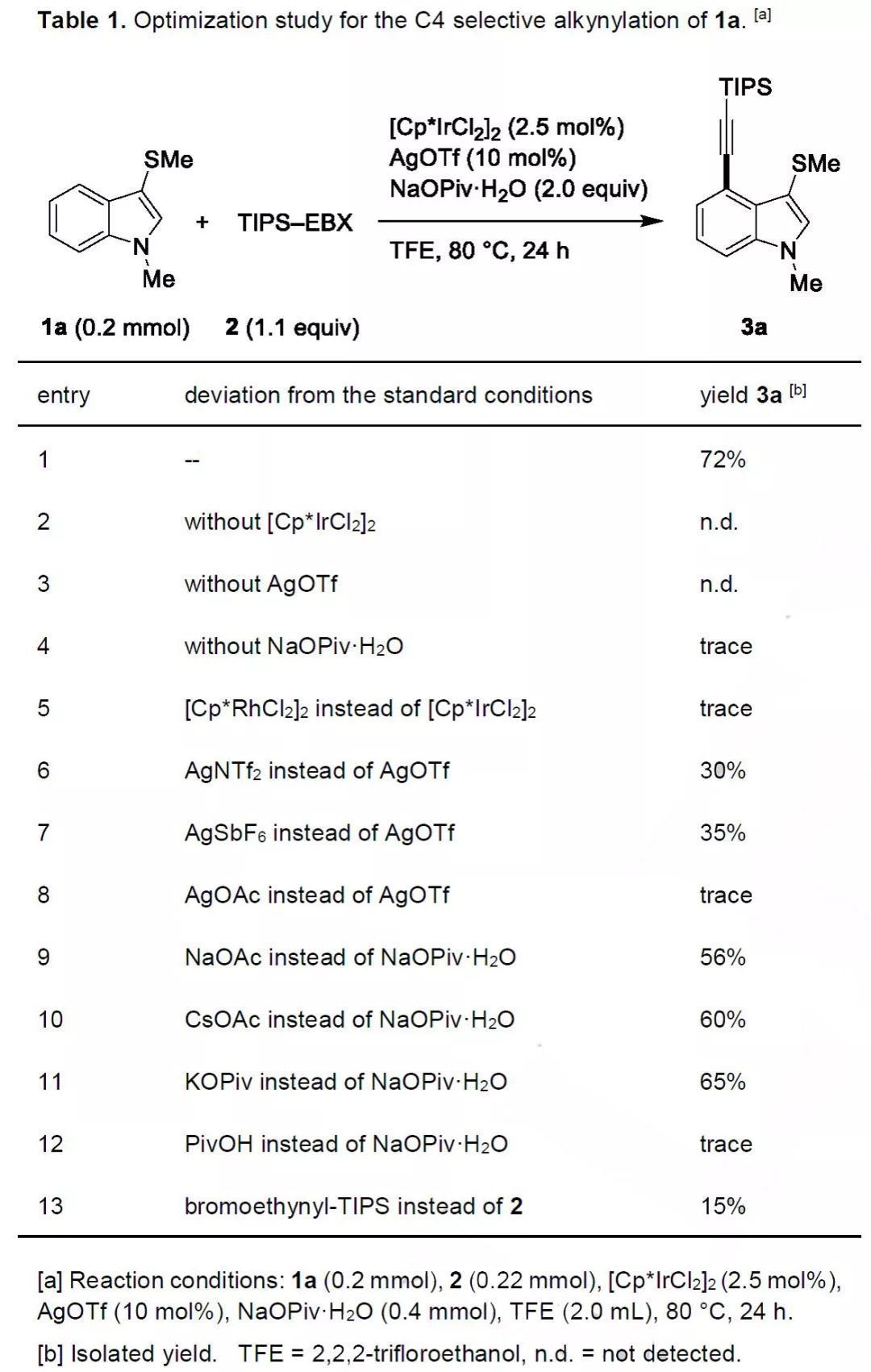
研究初期,作者以1-甲基-3-(甲硫基)-1H-吲哚(1a)為模型底物,TIPS-EBX(2)為炔基化試劑對(duì)C4炔基化反應(yīng)進(jìn)行條件優(yōu)化(Table 1)。在[Cp*IrCl2]2/AgOTf催化劑和NaOPiv·H2O添加劑存在下,1a和2在三氟乙醇中80 ℃下反應(yīng)能得到所需的偶聯(lián)產(chǎn)物3a,產(chǎn)率為72%(entry 1)。控制實(shí)驗(yàn)的結(jié)果表明,催化劑和添加劑都是反應(yīng)所必需的。
(來源:Angew. Chem. Int. Ed.)
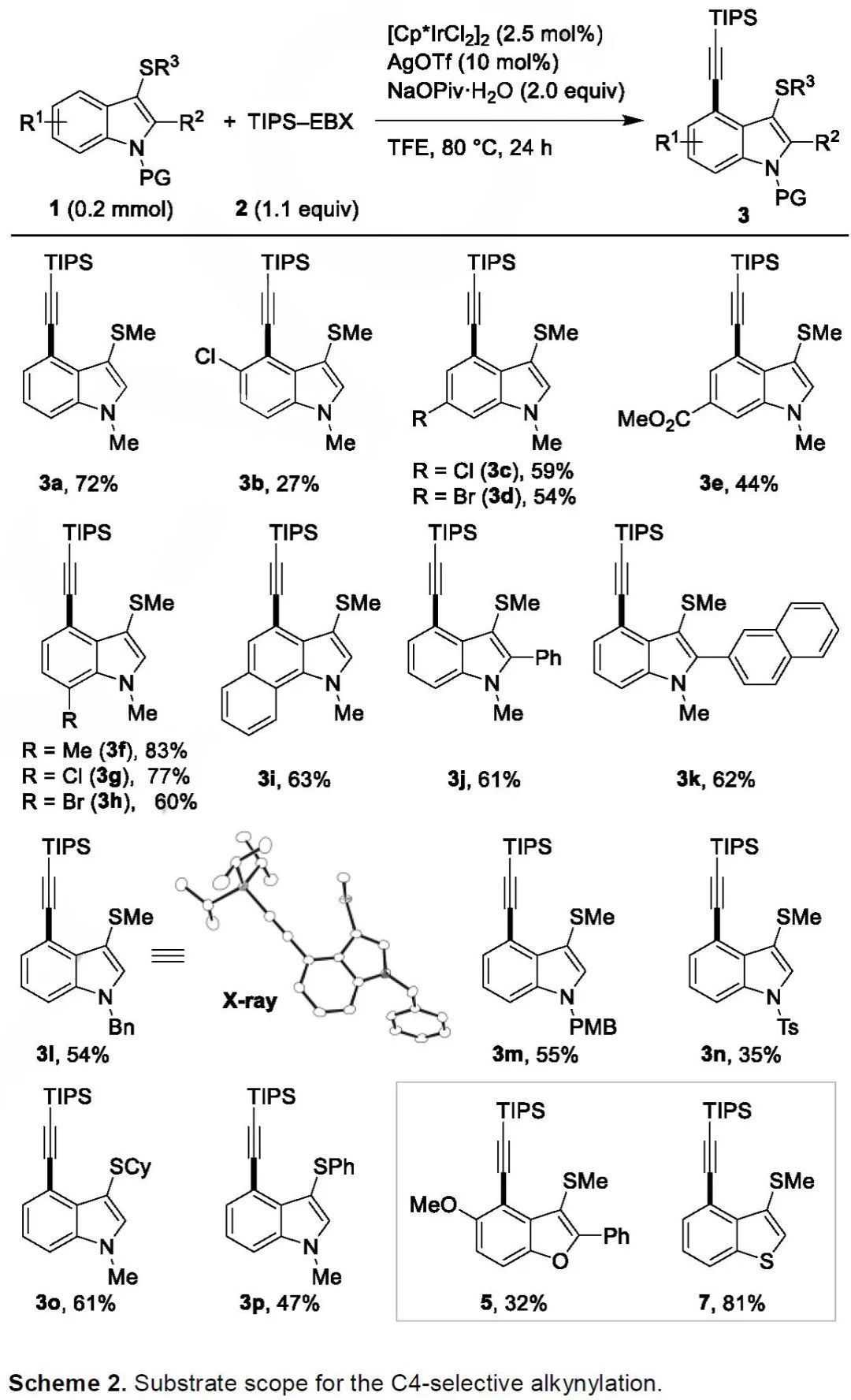
在最優(yōu)的反應(yīng)條件下,作者考察了吲哚類底物的適用范圍(Scheme 2)。該反應(yīng)對(duì)C4位附近的空間位阻較敏感,因此C5取代的吲哚反應(yīng)相當(dāng)緩慢。5-氯吲哚僅以27%的收率得到相應(yīng)的產(chǎn)物3b。在C6或C7位置帶有取代基的底物能以良好的收率順利得到炔基化產(chǎn)物3c-3h。1-甲基苯并吲哚或者C2位置連有苯基和萘基的吲哚也適用于該方法,且得到單一的C4炔基化合物3i-3k。此外,氮原子和硫原子上連有其他保護(hù)基的吲哚也具有良好的耐受性,并以中等收率得到C4炔基化產(chǎn)物(3l-3p)。值得注意的是,該反應(yīng)還適用于其他芳族化合物(5和7)的區(qū)域選擇性炔基化。
(來源:Angew. Chem. Int. Ed.)
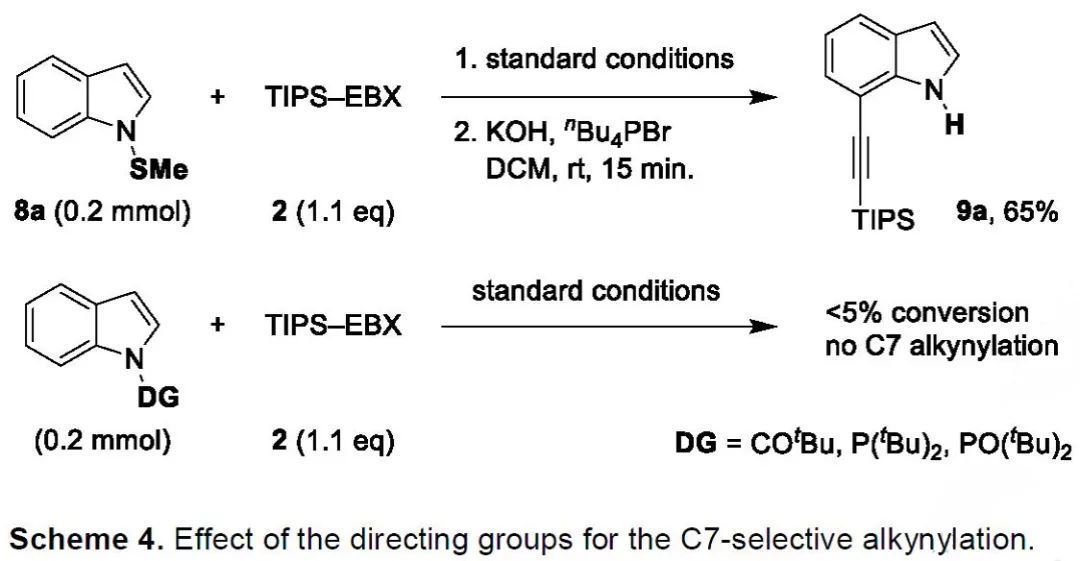
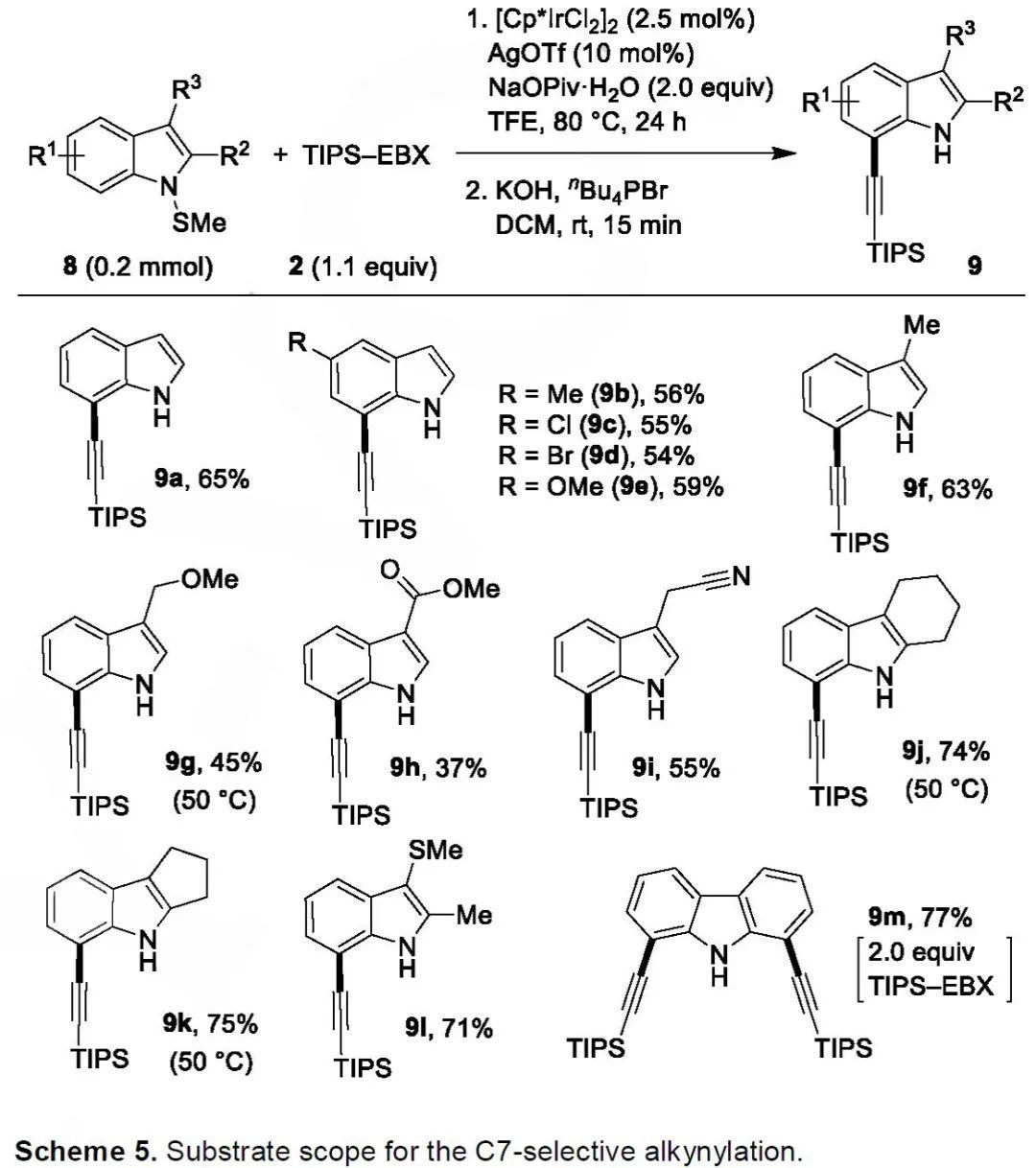
為進(jìn)一步證明硫?qū)虻娜不呗缘暮铣蓱?yīng)用,作者設(shè)想通過將SMe導(dǎo)向基安裝到吲哚氮原子上以實(shí)現(xiàn)C7選擇性官能化。有趣的是,將標(biāo)準(zhǔn)條件下1-(甲硫基)吲哚(8a)與TIPS-EBX(2)的反應(yīng)液經(jīng)堿性處理后,反應(yīng)以65%的收率得到了目標(biāo)C7炔基化的吲哚9a(Scheme 4)。
(來源:Angew. Chem. Int. Ed.)
如Scheme 5所示,該策略可以耐受多種官能團(tuán),例如氯、溴、酯基和氰基等(9b-9i)。C3位競(jìng)爭(zhēng)性導(dǎo)向基的存在并不會(huì)影響反應(yīng)的區(qū)域選擇性,僅得到C7炔基化吲哚9l。9-(甲硫基)-9H-咔唑也能參與反應(yīng),并且以77%的收率得到雙炔基化產(chǎn)物9m。
(來源:Angew. Chem. Int. Ed.)
總結(jié):Masahiro Miura課題組以TIPS-EBX為炔基化試劑,發(fā)展了首例吲哚苯環(huán)片段的催化炔基化方法。硫官能團(tuán)能正確地引導(dǎo)反應(yīng)進(jìn)程,并且得到了具有選擇性的C4和C7官能團(tuán)化吲哚,且硫?qū)蚧梢匀菀椎爻ァA硗猓摲磻?yīng)底物范圍廣泛,且可以耐受吲哚上的多種官能團(tuán)。








