蛋白質(zhì)磷酸化是最重要的翻譯后修飾過程之一,在細(xì)胞功能的很多方面(包括信號轉(zhuǎn)導(dǎo),基因表達(dá),代謝,細(xì)胞生長和酶促調(diào)節(jié))起著關(guān)鍵作用。可逆的磷酸化過程通常是由蛋白激酶和蛋白磷酸酶的負(fù)反饋作用引起的,可以通過調(diào)節(jié)細(xì)胞過程的信號開關(guān)來調(diào)節(jié)酶的“開/關(guān)”狀態(tài)。相同的激酶可以在許多不同的氨基酸殘基上調(diào)節(jié)蛋白質(zhì)的磷酸化,逐漸發(fā)生或分布性地發(fā)生多位點磷酸化過程。具有n個位點的蛋白質(zhì)的多位點磷酸化過程可能產(chǎn)生(2n-1)個磷酸化形式,并且每個單獨的磷酸化形式都可能具有獨特的生物學(xué)效應(yīng)。然而,從系統(tǒng)的角度研究多位點磷酸化的主要困難是不僅缺乏有關(guān)這些多位點磷酸化過程的深入機(jī)理,而且還缺乏有關(guān)個別磷酸形式的動態(tài)比例和作用信息。目前大多數(shù)分析方法僅表現(xiàn)了對單磷酸肽的關(guān)注,對于多磷酸肽的研究相對缺乏。這是由于在質(zhì)譜分析過程中多磷酸肽信號由于電離效率和含量較低,因此質(zhì)譜信號容易被單磷酸肽影響。中國科學(xué)院大連化學(xué)物理研究所吳仁安研究員團(tuán)隊構(gòu)建了雙金屬鋯-有機(jī)框架對多磷酸肽的高度特異性富集。圖1為制備屏蔽分子改性的MOF及用于多磷酸肽的富集過程。
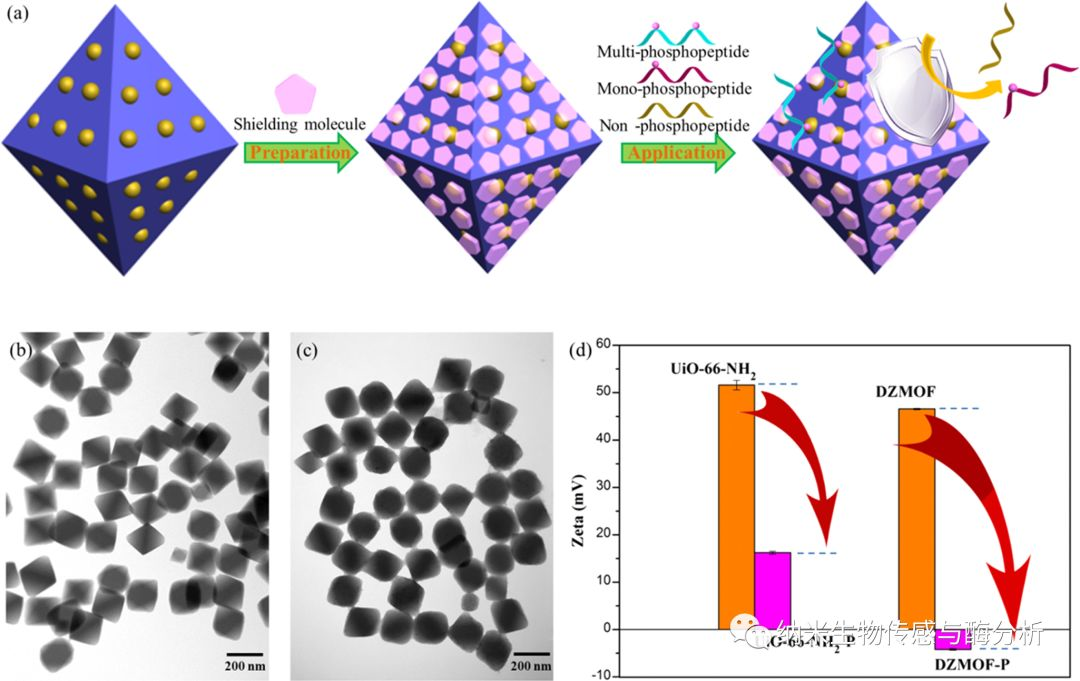
圖1. (a)制備改性后MOF及用于多磷酸肽的富集過程;(b)UiO-66-NH2 和DZMOF 透射電鏡圖;(c)UiO-66-NH2 和DZMOF經(jīng)單磷酸基團(tuán)改性后ζ電勢的變化。
實驗中,作者比較了UiO-66-NH2 和DZMOF經(jīng)單磷酸基團(tuán)改性后對酪氨酸胰蛋白酶降解物的富集效果。
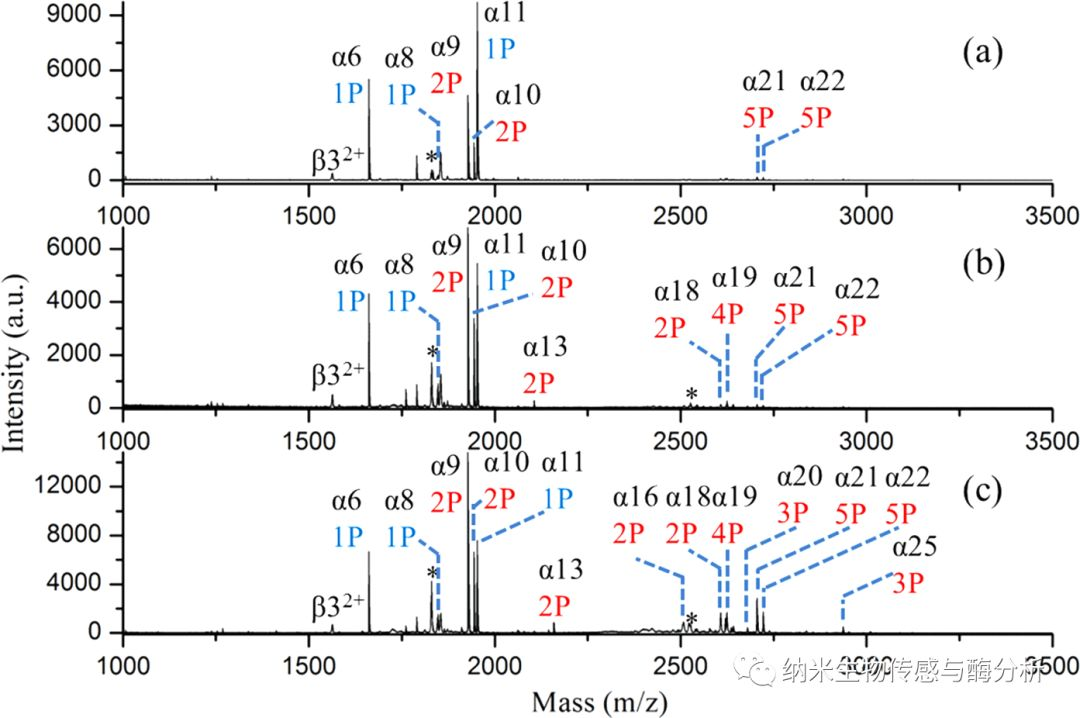
圖2. UiO-66-NH2 和DZMOF經(jīng)單磷酸基團(tuán)改性后富集的酪氨酸胰蛋白酶降解物飛行時間質(zhì)譜圖。
最后,進(jìn)一步比較了DZMOF 和DZMOF?FDP 對細(xì)胞降解物中單磷酸和多磷酸肽富集后的分布比例(如下圖)。
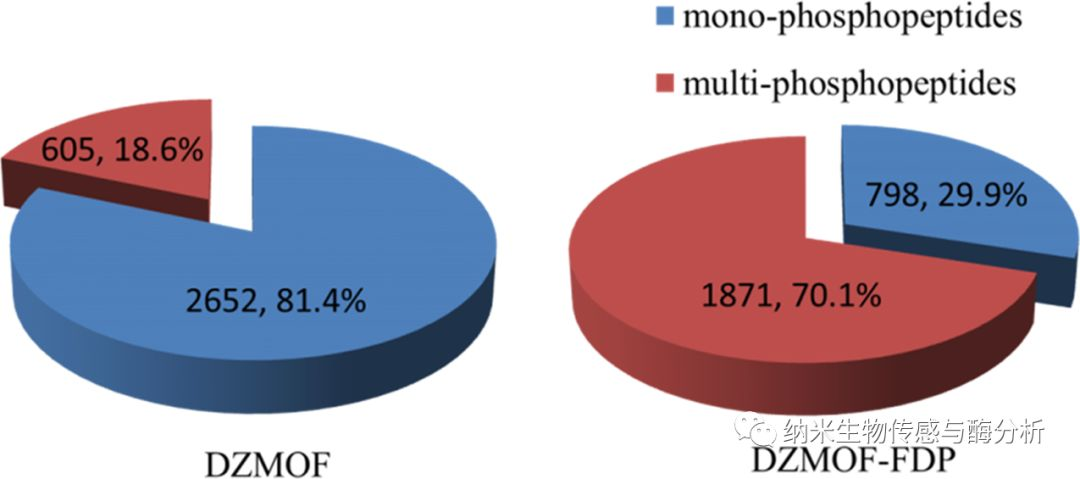
圖3. DZMOF 和DZMOF?FDP 對細(xì)胞降解物中單磷酸和多磷酸肽富集后的分布比例.
小結(jié):
具有兩個磷酸基團(tuán)(FDP)的親水果糖分子是調(diào)節(jié)MOF表面性能的有效改性劑。此外,通過分別控制改性劑和基質(zhì)的用量,發(fā)現(xiàn)不僅表面改性劑而且基質(zhì)材料也對多磷酸肽的特定富集做出了巨大貢獻(xiàn)。用FDP(DZMOF-FDP)修飾的以金屬為中心的雙金屬鋯-有機(jī)框架對模擬樣品中的多磷酸肽顯示出最佳選擇性。DZMOF-FDP對多磷酸肽的優(yōu)越特異性主要可歸因于兩個原因。首先是將親水性和柔性FDP分子應(yīng)用于DZMOF會生成具有富金屬基質(zhì)和二磷酸酯界面預(yù)配位的功能配體。FDP與DZMOF的金屬位點之間的強(qiáng)相互作用產(chǎn)生了很高的抗干擾性能,從而消除了非磷酸化肽和單磷酸肽的干擾。其次是在富集過程中多磷酸肽與DZMOF之間的牢固結(jié)合,可以取代DZMOF表面上的FDP分子。
這一成果發(fā)表在ACS Appl. Mater. Interfaces上。標(biāo)題為“Highly Specific Enrichment of Multi-phosphopeptides by the Diphosphorylated Fructose-Modified Dual-Metal-Centered Zirconium?Organic Framework” DOI: 10.1021/acsami.8b11138








