1簡介
在 組成、結(jié)構(gòu)和性能三者中,關(guān)鍵是結(jié)構(gòu)這個環(huán)節(jié),它上承組成,下啟性能。組成通過結(jié)構(gòu)的中介而聯(lián)系性能,可由晶體化學中相當普遍存在的 同分異構(gòu)現(xiàn)象為例來說明。如 方解石和 文石的成分同屬碳酸鈣,但因其 離子結(jié)合方式不同而具有迥然不同的 晶系和解理性。金剛石和 石墨均由 碳元素組成,但前者為透明、 硬度極高的 絕緣體,可用作 地質(zhì)鉆探用的 耐磨材料;而后者為黑色、硬度極低的良導體,可用作電極和“鉛” 筆芯的主要材料。兩者幾乎對立的性質(zhì),起源于其內(nèi)部鍵型、 構(gòu)型不同。金剛石中 碳原子通過定域的 共價鍵連結(jié)成架型的結(jié)構(gòu);具有層狀結(jié)構(gòu)的石墨及其層分子中 π電子的離域則與石墨之低硬度和高 電導率相聯(lián)系。20世紀50~60年代,曾廣泛應(yīng)用的殺蟲劑 六六六有α、β、γ等 異構(gòu)體(或稱 變體),其中只有γ變體才具有藥效。活性蛋白與 變性蛋白的同分異構(gòu)現(xiàn)象也是重要的實例,蛋白活性的喪失起因于高級結(jié)構(gòu)發(fā)生的變異。其他例證還有成分同為 1,4-聚 異戊二烯的 合成橡膠和古塔波膠;廣泛用作 催化劑載體的 氧化鋁的γ變體與α變體等。 晶體化學原理首先涉及鍵型、構(gòu)型以及它們隨組成而變異的規(guī)律,其原理的表達主要通過組成 晶體結(jié)構(gòu)的 原子、離子的數(shù)量關(guān)系、大小關(guān)系和作用力的本質(zhì)及其變異等 要素來進行。性能中首要的是決定某一物質(zhì)或化合物能否存在的穩(wěn)定性,而晶體及其所包含的分子的其他物理或 化學性質(zhì)也無不由其結(jié)構(gòu)來決定。 現(xiàn)代晶體化學是在大量實測系列晶體結(jié)構(gòu)信息的基礎(chǔ)上總結(jié)出規(guī)律的。因此,它一方面有其堅實的實踐基礎(chǔ),另一方面能對 材料科學、 合成化學、 生物化學、 地球化學和 礦物學等相鄰學科起重要的指導作用。
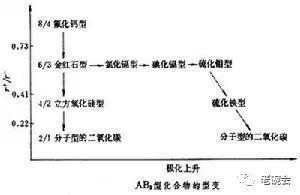
晶體化學起源于 晶體學向化學的滲透。在晶體學發(fā)展的經(jīng)典階段,人們還只能從觀察晶體的 多面體的外形來聯(lián)系晶體的組成和結(jié)構(gòu)。但這種聯(lián)系也曾對化學的發(fā)展作出巨大的貢獻。1819年德意志化學家E.米切利希發(fā)現(xiàn)異質(zhì)同晶現(xiàn)象。在當時,很多元素還只有當量而不知其 原子量,這一發(fā)現(xiàn)曾起過與 杜隆-珀替定律相仿的重要作用。在1850年前后,L. 巴斯德注意到了 酒石酸鹽晶體的 旋光性與其外形中缺乏 對稱中心和鏡面這一事實間的聯(lián)系。他在顯微鏡下拆分了 手征性不同的兩種酒石酸鹽晶體。這一發(fā)現(xiàn)對有機物 立體化學的發(fā)展有過深刻的影響。在19世紀下半葉,聯(lián)系晶體化學組成與晶體外形及 晶面夾角數(shù)據(jù)的工作,積累不少,主要概括于德國晶體學家 P.H.von 格羅特1919年出版的《化學晶體學》與俄國Ε.С. 費德羅夫1920年出版的《晶體界》兩書之中。 1912年德國M.von 勞厄?qū)wX射線衍射效應(yīng)的重要發(fā)現(xiàn),實為晶體學發(fā)展進程中的一個里程碑。它為 X射線晶體學的誕生奠定了基礎(chǔ),從而使經(jīng)典晶體學過渡到 現(xiàn)代晶體學。在X射線晶體學的初創(chuàng)時期,即使像 氯化鈉等 簡單離子化合物的結(jié)構(gòu),對于化學家來說還是個難題,他們套用 有機結(jié)構(gòu)理論中關(guān)于 原子價和分子等概念而陷入困境。但在1913年, 離子化合物氯化鈉和無機 單質(zhì)金剛石在晶體學家手中卻是作為最簡單的結(jié)構(gòu)問題予以解決了。此時化學家才明白,在這些簡單無機晶體中并不存在分立的分子集團。這些重要而又屬于啟蒙性的 晶體結(jié)構(gòu)知識為 無機物的晶體化學開辟了良好的前景。基于這一歷史背景,在1913~1929年這一時期,晶體學家選擇無機單質(zhì)和離子化合物作為主要對象,進行了相當系統(tǒng)的研究。在這個時期中,W. 科塞爾、G.N. 路易斯、N.V.西奇威克和I. 朗繆爾提出和發(fā)展了關(guān)于 電價結(jié)合(見 離子鍵)和共價結(jié)合(見 共價鍵)的理論。 離子半徑的主要研究者有德國的V.M. 戈爾德 施米特和美國的L.C. 鮑林等。離子化合物 點陣能問題的主要研究者有M. 玻恩,A.朗德,F(xiàn). 哈伯和E. 馬德倫等。 離子極化和變形的主要研究者是K. 法揚斯。1927年戈爾德施米特在簡單離子化合物晶體結(jié)構(gòu)材料的基礎(chǔ)上,提出了他的晶體化學定律:“晶體的結(jié)構(gòu)取決于其組成者(原子、離子和 原子團)的數(shù)量關(guān)系、大小關(guān)系和極化性能。”對于離子化合物來說,定律中所說組成者的數(shù)量關(guān)系是指正、 負離子的數(shù)量比,組成者的大小關(guān)系是指正、負離子的 半徑比,組成者的極化性能主要是指負離子的 可極化性和 正離子的 極化力(負離子電價低, 半徑大,一般易被極化;正離子半徑越小,極化能力越大)。當正、負離子間極化因素增強時,離子鍵將在一定程度上向共價鍵過渡,從而導致產(chǎn)生 鍵長縮短、 鍵能遞增、正 離子配位多面體偏離高對稱性、產(chǎn)生畸變等效應(yīng)。晶體化學定律高度概括了決定化合物結(jié)構(gòu)型式的組成者的三個結(jié)構(gòu)要素。在 無機化合物的晶體化學中,一般按代學式(即組成比)的類型AB、AB2等分類進行討論。就同一類 化學式的化合物來說,戈爾德施米特將晶體結(jié)構(gòu)型式隨組成者大小關(guān)系和極化性能的遞變而產(chǎn)生的變化稱為型變。事實上晶體的結(jié)構(gòu)型式還將受溫度、壓力等外界條件的影響。同一化合物或單質(zhì)在不同條件下可生成不同型式的 同分異構(gòu)體。這種現(xiàn)象又稱為 多晶型現(xiàn)象。戈爾德施米特定律的概念極為清晰,但其適用范圍主要局限于組成比簡單的無機化合物。1913~1929年,以W.L.布喇格和鮑林為代表的晶體學家,從事以 硅酸鹽為主體的大量復(fù)雜 含氧酸鹽的晶體結(jié)構(gòu)研究。這些研究促進了無機晶體化學第一次繁榮的高潮,它以鮑林總結(jié)、提出的五個關(guān)于 離子晶體結(jié)構(gòu)的 鮑林規(guī)則為標志。在鮑林規(guī)則的表述中,突出了形成離子配位多面體的原理及制約 配位多面體間相連接的規(guī)律,并將它與離子晶體結(jié)構(gòu)穩(wěn)定性的問題聯(lián)系起來。在離子晶體中,正離子應(yīng)當位于負離子形成的配位多面體( 正四面體、正 八面體、 立方體、立方八面體等)的中心。第一規(guī)則涉及“負離子配位多面體的大小和型式主要取決 于正、負離子半徑和與半徑比”的問題。第二規(guī)則即 電價規(guī)則,是五個規(guī)則的核心,它涉及多面體 頂角如何公用的問題。規(guī)則定義每個離子鍵的 靜電鍵強度 s為離子電價ω 除以 配位數(shù) v(即s=ω/v)。對穩(wěn)定的離子晶體, 負離子的電價將接近或等于其鄰接諸離子鍵的鍵強之和。第三規(guī)則涉及多面體公用棱和面將降低結(jié)構(gòu)穩(wěn)定性的問題。第四規(guī)則涉及什么樣的正離子多面體不鄰接的問題。第五規(guī)則要求同一種離子的結(jié)合方式趨于最少。戈爾德施米特定律和鮑林規(guī)則等晶體化學原理對 無機化學、 礦物學、水泥陶瓷工業(yè)等的發(fā)展起了重大的推動作用。到了70年代,著名的鮑林電價規(guī)則已被以加拿大I.D.布朗為代表的晶體化學家進一步發(fā)展為 價鍵理論。這一理論對復(fù)雜無機化合物的 結(jié)構(gòu)化學有重大的指導意義。 按晶體化學的分類系統(tǒng),無機物的晶體主要劃分為單質(zhì)、 二元化合物、多元化合物、含氫化合物、合金等體系。 在金屬單質(zhì)中,基于 金屬鍵的特征,可將金屬單質(zhì)的 立體結(jié)構(gòu)歸結(jié)為等徑圓球的密堆積。在金屬單質(zhì)中占主導地位的結(jié)構(gòu)型式為與A1、A2、A3符號對應(yīng)的立方 最密堆積、立方體 心密堆積和 六方最密堆積。 對非金屬單質(zhì),因其中定域共價鍵占主導地位,起支配作用的結(jié)構(gòu)化學規(guī)律是8-N規(guī)則。N是 非金屬元素所屬的族數(shù),8-N是指每個原子與鄰近原子可形成共價(單)鍵的數(shù)目。如對硫和硒,N=6,則每個硫或硒原子鄰接 原子數(shù)為8-N=2,因而硫和硒可形成環(huán)狀或鏈狀的分子。 簡單二元離子化合物的典型結(jié)構(gòu)有氯化鈉型、 氯化銫型、立方 硫化鋅型、六方硫化鋅型、 氟化鈣型和 金紅石型等。在一般場合,因負離子的半徑大,它在占據(jù)空間上起主導作用, 因而多采取A1型、A3型或其他的緊密堆積方式,而正離子則按正、負離子半徑比而占據(jù)負離子在密堆積中所形成的 四面體、八面體等多面體孔隙。例如,氯化鈉的結(jié)構(gòu)可描述為 氯離子作A1型立方最密堆積,而 鈉離子 Na+則占滿全部Cl-所形成的 八面體空隙。在氟化鈣中,F(xiàn)-作簡單立方堆積,而所有Ca2+離子則占據(jù)半數(shù)由F-所形成的立方體空隙。上述實為兩種半徑不同的圓球密堆積問題。對于二元離子化合物,由于整個晶體必須保持 電中性,正、負離子的電價比和配位數(shù)比必然受正、負離子數(shù)量比的制約如下:關(guān)于正、負離子半徑比r+/r-和極化因素變遷對結(jié)構(gòu)型式的影響,可以AB2型化合物的型變規(guī)律為例說明之(見圖)。當r+/r-下降時,極化程度將上升而導致高對稱的離子性結(jié)構(gòu)氟化鈣型和金紅石型通過過渡的 二氧化硅型而向分子型的二氧化碳結(jié)構(gòu)型轉(zhuǎn)化。另外,隨著 過渡元素極化力之增強及負離子可極化性的上升,高對稱的構(gòu)型將通過 氯化鎘、 碘化鎘、硫化鉬等層型結(jié)構(gòu)向 島型的結(jié)構(gòu)型過渡。多元化合物的類型甚多,包括各種簡單和復(fù)雜的含氧酸鹽、各種金屬 配合物和 簇合物等。對于離子性成分高的化合物晶體,鮑林規(guī)則具有重要的指導作用。對于 原子簇金屬化合物,晶體結(jié)構(gòu)所提供的原子鍵合方式和關(guān)于鍵長、 鍵角的信息將對成鍵本質(zhì)的了解和成簇規(guī)律的總結(jié)提供重要的依據(jù)。例如,一般可根據(jù)金屬原子間的距離來判斷是否有含金屬鍵成分的M-M鍵的存在等。 對于含氫體系,如酸、酸性鹽、 氫氧化物、 水合物等,需要強調(diào)的是最大限度地形成 氫鍵的晶體化學原理。 在合金體系中,占主導地位的組成者是 電負性小(或電正性大)的元素。合金中的 物相一般可分為金屬 固溶體和 金屬化合物兩種類型,金屬化合物又分為組成可變和組成確定的兩種。一般,組成者的電化學性質(zhì)(主要指電負性)、 原子半徑、單質(zhì)結(jié)構(gòu)型式越相近,則生成固溶體的傾向越大;電化學性質(zhì)和原子半徑相差越大,則生成金屬化合物的傾向就越大。合金體系一般多用多晶 粉末法結(jié)合 相圖、化學圖進行研究。合金體系的晶體 化學與材料科學關(guān)系密切,在國民經(jīng)濟中有重要意義。 蛋白質(zhì)晶體化學,研究蛋白質(zhì)晶體結(jié)構(gòu)的 物理化學分支學科。蛋白質(zhì)分子是由上百或更多的α- 氨基酸作為單體 縮合而成的 多肽(見肽)鏈構(gòu)成的。能構(gòu)成蛋白質(zhì)中 多肽鏈的 α-氨基酸總共有 20種L-氨基酸。通過它們不同的組合和排列形成氨基酸順序不同的多肽鏈,然后這些多肽鏈進一步通過交聯(lián)構(gòu)成千萬種蛋白質(zhì)分子。 晶體化學的發(fā)展與 有機化學關(guān)聯(lián)的密切程度并不亞于無機化學。在它發(fā)展的前期,涉及 有機化合物的代表性研究工作有1923年R.G. 迪金森測定第一個有機物晶體六 亞甲基四胺的結(jié)構(gòu);1947年C.W. 布恩對 耐綸66 晶體結(jié)構(gòu)的研究;1949年D.克勞富特等完成了 青霉素衍生物 芐青霉素的結(jié)構(gòu)研究;1952年初步測定了第一個夾心式 金屬有機化合物 二茂鐵的晶體結(jié)構(gòu);在40~50年代,蘇聯(lián)晶體化學家Α.И.基泰戈羅茨基在有機物的晶體化學上也取得很大的成就,1955年他曾出版了《有機晶體化學》一書。 自1966年以后,由于計算機控制的自動 單晶衍射儀和與之匹配的 晶體結(jié)構(gòu)分析軟件的迅速發(fā)展和普及,X射線 晶體學方法成為取得 有機分子 立體結(jié)構(gòu)和 鍵參數(shù)最有效和得力的工具。1977年所測有機化合物和金屬有機化合物的晶體結(jié)構(gòu)數(shù)量已超過三千項。這些大量的晶體化學信息已為深入研究 有機反應(yīng)機理、指導合成和深入探討有機物分子 構(gòu)型和 構(gòu)象與分子化學活性間的內(nèi)在聯(lián)系提供了可靠的依據(jù)。 晶體化學家在 生物大分子結(jié)構(gòu)研究中的貢獻也是巨大的。鮑林在1951年提出了多肽的 α 螺旋體。J.D. 沃森等受此啟示,進一步在1953年提出脫氧 核糖核酸 雙螺旋模型,初步解開了 遺傳信息之謎。1957年J.C. 肯德魯發(fā)表了具 6埃分辨率的 肌紅蛋白的結(jié)構(gòu)。這使人們第一次看到一個蛋白分子的 立體圖像。1959年M.F.佩魯茲經(jīng)過多年的奮斗終于用 同晶置換法解出了 血紅蛋白的結(jié)構(gòu)。這兩大發(fā)現(xiàn),為肌紅和血紅蛋白的載氧功能的闡明提供了結(jié)構(gòu)基礎(chǔ)。1965年D. 菲利普斯測定了 溶菌酶的三維結(jié)構(gòu)。1967年W.N.Jr. 利普斯科姆測定了羧 肽酶 A的結(jié)構(gòu),揭示了酶功能專一性問題。到1986年為止,用晶體學方法測定生物大分子的結(jié)構(gòu)累計已達280個左右。 晶體化學在 近代自然科學中的地位可簡單地歸納如下:①晶體化學起源于晶體學向化學的滲透;②因很多材料(如合金、 分子篩等)只存在于晶態(tài)之中,再者,分子立體結(jié)構(gòu)知識的主要來源是晶體結(jié)構(gòu),所以,當今晶體化學已成為 結(jié)構(gòu)化學信息的主要源泉;③晶體化學在當今自然科學中有廣泛的橫向聯(lián)系,它不僅是研究化學反應(yīng)機理和化合物 構(gòu)效關(guān)系的指南,而且已成為 材料科學和 分子生物學深入發(fā)展的支柱。2簡史
3研究內(nèi)容
 型變規(guī)律
型變規(guī)律4進展








