定義
鈀催化的有機硼化合物與有機鹵化物或三氟甲磺酸鹽進行交叉偶聯反應,生成碳-碳鍵的一種強大而通用的方法
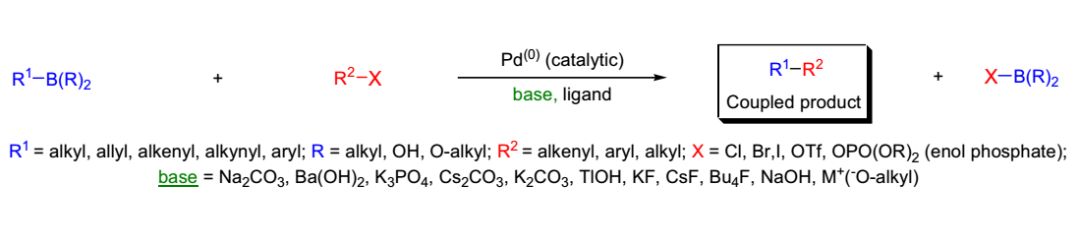
反應通式
起源與發展
1979年,A. Suzuki和N. Miyaura報道了1-烯基硼烷和芳基鹵化物在鈀催化劑存在下的立體選擇性合成(E)芳基烯。
反應的一般特征
3)無機副產物容易從反應混合物中去除,使反應適合工業化;7) sp3雜化的烷基硼烷也可以通過B-烷基Suzuki-Miyaura交叉偶聯進行1)芳基鹵化物反應遲緩;2)溶劑-溶解氧形成自偶聯產物等副產物;3)常形成與膦結合的芳基偶聯產物;4)由于該反應在沒有堿的情況下不能進行,因此會發生諸如旋光化合物的外消旋化或醛醇縮合等副反應
機理
鈴木交叉偶聯反應的機理類似于其他交叉偶聯反應的催化循環,有四個不同的步驟:1)有機鹵化物氧化加成Pd(0)-形成Pd(II);2)將鈀上的陰離子交換為堿的陰離子(轉化法);3) Pd(II)與烷基硼酸配合物的金屬轉換;4)還原消除形成C-C 單鍵和Pd(0)再生。雖然有機硼酸不能與Pd(II)-配合物發生金屬轉換,但相應的鹽配合物很容易發生金屬轉換。帶陰離子的硼原子的極化增加了烷基的親核性,并在轉金屬過程中加速了硼原子向鈀的轉移。非常大的和電子富配體(如P(t-Bu)3)通過加速氧化加成步驟的速率增加了原本不反應的芳基氯化物的反應活性。
反應實例
1) DOI: 10.1021/op800148y
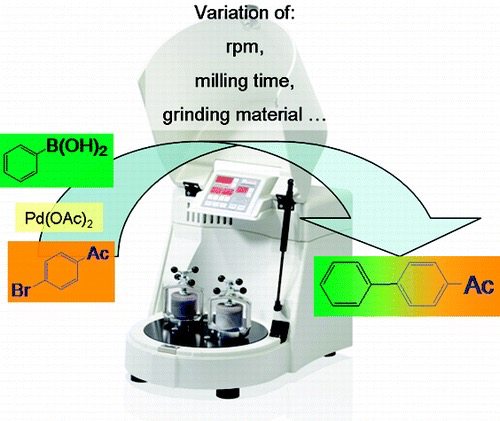
2) DOI: 10.1021/acscatal.7b03688
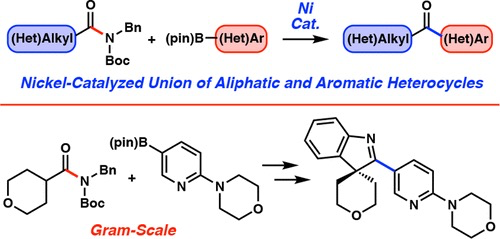
3) DOI: 10.1021/jacs.6b12329
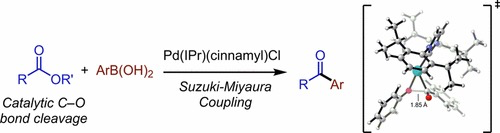
4) DOI: 10.1021/acscatal.9b03667
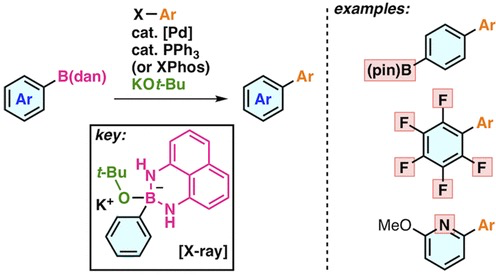
5) DOI: 10.1021/ja207759e
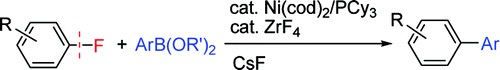
6) https://doi.org/10.1038/s41557-019-0346-2
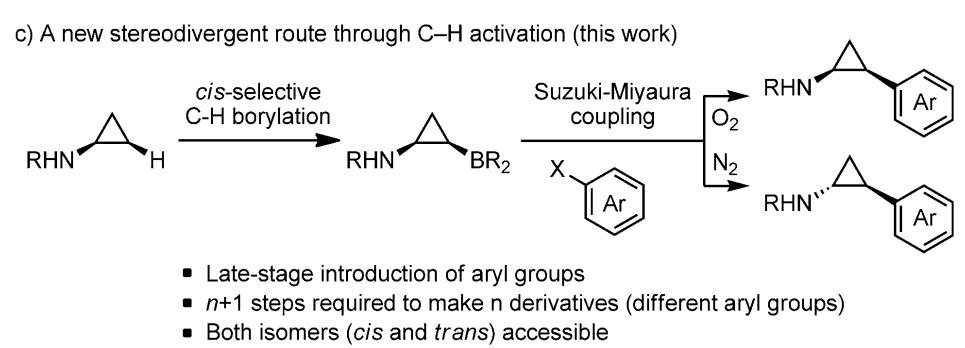
7) DOI:10.1038@s41467-019-14016-1
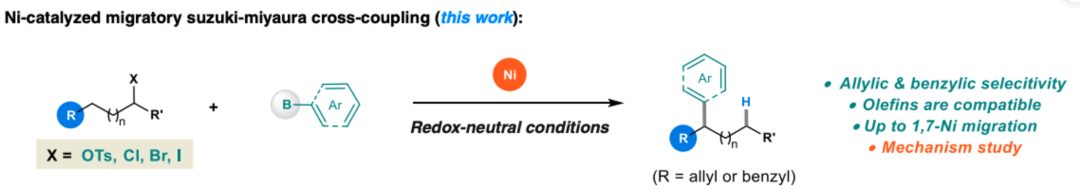
評述
Suzuki-Miyaura交叉偶聯的改進包括開發促進不反應的芳基鹵化物偶聯的催化劑,雜化烷基鹵化物反應的能力,以及使用烷基、烯基、芳基和烷基三氟硼酸代替硼酸等。Suzuki-Miyaura交叉偶聯反應,發現至今,已經成為有機合成中非常重要的反應。
參考



















