帶有軸手性的聯烯化合物是一類重要的合成中間體[1], 同樣存在于各類天然產物和藥物中[2]. 鑒于其重要性, 近二十多年來, 化學家們報道了各種各樣的手性聯烯合成方法[3], 包括動力學拆分、不對稱去對稱化、不對稱Wittig反應及炔丙基化合物的羧基化等.
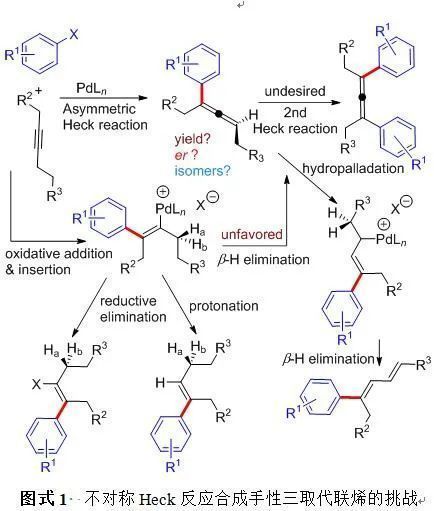
另一方面, 烯烴與芳基鹵代物的Heck反應是構建碳碳鍵的一個極為重要手段. 然而, 相應的用于合成聯烯的炔烴與芳基鹵代物的Heck反應卻發展緩慢(Scheme1), 其原因在于: (1)反應活性低, 即烯基鈀物種較難發生β-H消除, 盡管鄰位帶有取代基的芳基鹵代物可以一定程度上促進該過程[4], 但是反應的底物范圍受到限制;(2)化學選擇性存在問題, 由于β-H消除困難導致烯基鈀鹵代物的還原消除相對容易, 從而生成四取代的烯基鹵代物[5]; (3)由于β-H消除困難, 烯基鈀物種可能發生質子化生成苯乙烯類化合物; (4)聯烯產物不穩定, 容易進一步異構化生成共軛二烯[6]或者進一步發生第二次Heck反應生成四取代聯烯[7]. 目前通過催化劑的控制只能實現消旋的炔烴Heck反應[8]. 如何實現反應的活性、化學選擇性及對映選擇性的同時調控得到手性三取代聯烯化合物至今未有報道. 為實現該類重要的不對稱反應,新型手性配體和催化劑的發展和應用占有關鍵的地位.
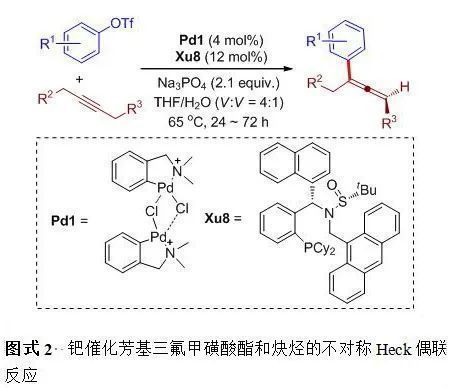
麻生明[3]團隊長期致力于聯烯化學研究, 發展了一系列聯烯類化合物的高效合成、轉化的方法和策略. 復旦大學張俊良團隊[9]一直致力于一類帶有亞磺酰胺片段的手性膦配體Sadphos的設計、合成及在重要不對稱催化反應中的應用研究(圖1). 最近, 麻生明和張俊良團隊合作成功解決了上述諸多挑戰, 報道了Xu-Phos/Pd催化的芳基三氟甲磺酸酯與炔烴的不對稱Heck反應[10], 以良好的收率和優秀的對映選擇性得到手性的三取代聯烯化合物(Scheme 2). 反應具有良好的底物范圍(>32個實例), 可以兼容常見的芳基氯、烷基氯、酯基、醛基、酮及保護的胺基等官能團(圖2). 另外, 反應可以順利放大至克級規模, 具有良好的合成應用價值和潛力.值得一提的是, 軸手性的三取代聯烯可通過不同的轉化得到中心手性的化合物, 例如手性的2,5-二氫呋喃和帶有α手性中心的烯烴(Scheme 3). 此外, 作者對機理進行了研究, 發現不加堿同樣可以得到目標產物, 從而排除了堿輔助的不對稱去質子化過程.



總之, 麻生明和張俊良團隊發展了一類氮原子上帶有大位阻取代基的Xu-Phos手性配體, 與鈀結合成功實現了簡單易得的芳基三氟甲磺酸酯與炔烴的不對稱Heck偶聯反應, 以良好的收率和優秀的對映選擇性獲得了軸手性三取代聯烯產物. 該類軸手性聯烯產物可以轉化成中心手性的化合物. 該研究為手性聯烯的高效合成提供了新途徑, 進一步豐富了不對稱鈀催化偶聯化學.
該文發表在Chin.J.Org.Chem.2020,40(3):810-811. DOI:10.6023/cjoc202000013








