近日,南方科技大學(xué)王杰課題組在J. Am. Chem. Soc.雜志上發(fā)表了題為“Design and Evolution of A Phosphorescent Protein via the Proximal Encoding of Lanthanide and the Antenna Chromophore”的論文。

遺傳編碼的熒光蛋白(FPs)是生物過(guò)程可視化和分子檢測(cè)的重要工具,極大地推動(dòng)了我們對(duì)生命系統(tǒng)結(jié)構(gòu)和功能特性的理解。新型熒光蛋白的開(kāi)發(fā)對(duì)成像和檢測(cè)技術(shù)的發(fā)展具有重要的推進(jìn)作用,例如多色、光激活和抗光漂白熒光蛋白的研究促進(jìn)了多通道成像、檢測(cè)、超分辨成像和長(zhǎng)時(shí)間成像的發(fā)展。然而,現(xiàn)有熒光蛋白的熒光壽命仍局限于納秒(ns)級(jí),而具有超長(zhǎng)發(fā)光壽命的磷光蛋白(微秒-毫秒級(jí)發(fā)光壽命)仍是該領(lǐng)域尚未探索的前沿。
開(kāi)發(fā)長(zhǎng)發(fā)光壽命的可遺傳編碼的磷光蛋白(PPs)將在生物檢測(cè)、診斷和成像應(yīng)用中發(fā)揮明顯優(yōu)勢(shì)。這種蛋白的發(fā)光信號(hào)能在背景熒光和其他熒光信號(hào)消失后持續(xù)存在,從而創(chuàng)建光學(xué)信號(hào)的正交檢測(cè)窗口,實(shí)現(xiàn)時(shí)間分辨檢測(cè)(TRD),顯著提高信噪比和檢測(cè)靈敏度。然而,長(zhǎng)壽命磷光蛋白的開(kāi)發(fā)面臨重大技術(shù)挑戰(zhàn)。盡管通過(guò)定向進(jìn)化的方式可以有效提高熒光蛋白的穩(wěn)定性、亮度以及顏色,但其熒光壽命仍局限在納秒范圍,說(shuō)明通過(guò)傳統(tǒng)的定向進(jìn)化實(shí)現(xiàn)從熒光蛋白到磷光蛋白的轉(zhuǎn)換效果有限。化學(xué)標(biāo)記的方法雖可引入長(zhǎng)壽命探針,但存在標(biāo)記選擇性和背景干擾問(wèn)題。
在長(zhǎng)壽命熒光的生色團(tuán)或發(fā)光分子中,鑭系金屬具有窄發(fā)射帶和長(zhǎng)發(fā)光壽命的特性,但其消光系數(shù)低,導(dǎo)致單獨(dú)的鑭系金屬離子發(fā)光強(qiáng)度較弱。有研究表明,具有強(qiáng)吸收的有機(jī)配體可通過(guò)分子內(nèi)能量轉(zhuǎn)移敏化鑭系金屬,該策略在保持鑭系復(fù)合物長(zhǎng)發(fā)光壽命的同時(shí)顯著增強(qiáng)其發(fā)射強(qiáng)度。受此啟發(fā),作者提出將鑭系金屬螯合與敏化兩個(gè)過(guò)程集成于單一蛋白中,設(shè)計(jì)出磷光蛋白:利用多肽或蛋白的側(cè)鏈簇(如LBT和LanM)螯合鑭系金屬,并在金屬螯合位點(diǎn)附近引入光敏非天然氨基酸(UAAs),從而構(gòu)建磷光蛋白(圖1A)。此設(shè)計(jì)中,溶液中游離的鑭系金屬離子因缺乏敏化劑結(jié)合產(chǎn)生極其微弱的磷光,而游離UAAs因熒光壽命短,其熒光信號(hào)可通過(guò)時(shí)間分辨檢測(cè)的方式過(guò)濾掉。因此,長(zhǎng)壽命磷光信號(hào)僅來(lái)自同時(shí)引入U(xiǎn)AAs并螯合了鑭系金屬的蛋白,從而實(shí)現(xiàn)高信噪比、正交信號(hào)、免洗檢測(cè)等一系列性能。
這項(xiàng)工作中,作者設(shè)計(jì)了可遺傳編碼的磷光蛋白,并通過(guò)定向進(jìn)化提升其磷光強(qiáng)度。首先將熒光UAA作為敏化基團(tuán)引入對(duì)鑭系金屬具有高親和力(皮摩爾級(jí))的LanM蛋白中,經(jīng)系統(tǒng)篩選UAA插入位點(diǎn),獲得了鑭系金屬磷光強(qiáng)度較野生型(WT)LanM提升約十倍的起始突變體。然后通過(guò)定向進(jìn)化使LanM變體的磷光信號(hào)進(jìn)一步增強(qiáng)五倍,再通過(guò)化學(xué)進(jìn)化改造敏化基團(tuán)結(jié)構(gòu),磷光信號(hào)進(jìn)一步提升十倍。最終獲得的遺傳編碼磷光蛋白具有長(zhǎng)激發(fā)波長(zhǎng)、高亮度、長(zhǎng)達(dá)500微秒(μs)的發(fā)光壽命的特點(diǎn)。成功用于銪離子(Eu3+)傳感器、蛋白酶檢測(cè)系統(tǒng)和免疫熒光成像試劑的開(kāi)發(fā),表明該磷光蛋白可通過(guò)時(shí)間分辨檢測(cè)構(gòu)建高靈敏、高特異性的基因編碼傳感器平臺(tái)。
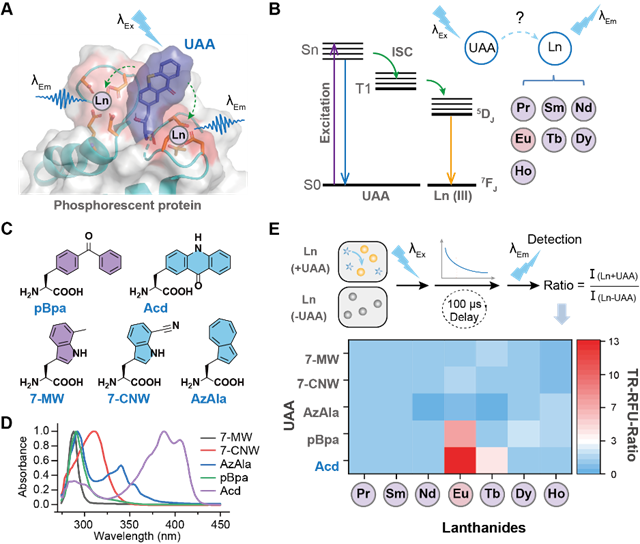
圖1 磷光蛋白的設(shè)計(jì)及UAA-Ln (III)的能量配對(duì)篩選
1. 磷光蛋白長(zhǎng)壽命發(fā)光系統(tǒng)的建立
作者首先從篩選發(fā)光中心和敏化基團(tuán)入手。鑭金屬獨(dú)特的4f軌道,f-f躍遷可產(chǎn)生窄發(fā)射帶和長(zhǎng)熒光壽命,但其低摩爾消光系數(shù)導(dǎo)致直接激發(fā)效率低。通過(guò)“天線(xiàn)效應(yīng)”,有機(jī)配體吸收光能后經(jīng)系間竄越將能量轉(zhuǎn)移至鑭系金屬離子(如Eu3?),可顯著增強(qiáng)金屬磷光(圖1B)。基于此,作者篩選了5種可基因編碼的熒光UAAs(圖1C-D),測(cè)試其與7種鑭系金屬離子(Ln3?)的能量轉(zhuǎn)移效率(圖1E)。結(jié)果顯示,Acd對(duì)Eu3?的敏化效果最佳,其磷光強(qiáng)度相對(duì)其他組合高10倍以上(圖1E),因此選擇Acd-Eu3?為最適的能量轉(zhuǎn)移對(duì)。
為了將非天然氨基酸Acd引入到蛋白質(zhì)中,作者通過(guò)篩選實(shí)驗(yàn)室存有的PylRS突變體庫(kù),成功獲得可特異性識(shí)別Acd的氨酰tRNA合成酶Acd-RS。接下來(lái),作者尋找到一種適合開(kāi)發(fā)磷光蛋白的鑭系元素結(jié)合蛋白——LanM蛋白,它對(duì)鑭系金屬具有非常高的親和力(皮摩爾級(jí))和選擇性。此外,LanM還具有可遺傳編碼、分子量小(<12 kDa)以及易于工程改造的特點(diǎn),使其成為開(kāi)發(fā)新型磷光蛋白的理想候選蛋白。考慮到LanM能夠結(jié)合3-4個(gè)鑭系元素,因此作者接下來(lái)在LanM蛋白中設(shè)計(jì)了42個(gè)Acd的引入位點(diǎn),基于磷光信號(hào)強(qiáng)度挑選出Acd可高效地將能量傳遞給多個(gè)Eu3?的突變體。經(jīng)過(guò)磷光信號(hào)的測(cè)定發(fā)現(xiàn),T65、T90和T114位點(diǎn)插入Acd時(shí)磷光信號(hào)最強(qiáng)(圖2)。
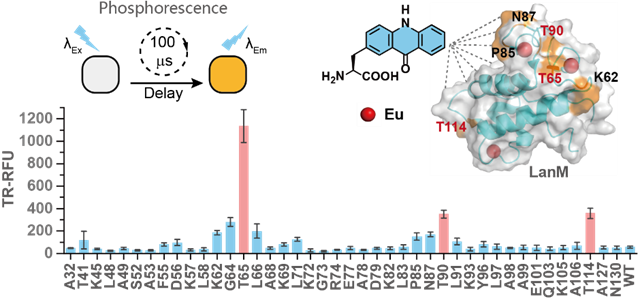
圖2 光敏非天然氨基酸在磷光蛋白中編碼位點(diǎn)的篩選
2. 磷光蛋白的設(shè)計(jì)與優(yōu)化
接下來(lái)作者基于磷光信號(hào)強(qiáng)度測(cè)定的方式,對(duì)這三個(gè)變體分別進(jìn)行兩輪定向進(jìn)化(圖3A):第一輪通過(guò)易錯(cuò)PCR構(gòu)建突變庫(kù)(圖3B-C),篩選到信號(hào)增強(qiáng)的變體(如F34L使T90-Acd信號(hào)提升6倍);第二輪結(jié)合易錯(cuò)PCR、多位點(diǎn)飽和突變和有益突變重組建庫(kù),最終獲得磷光信號(hào)提升10倍的LanMELE-T90Acd等變體(圖3D-E)。整個(gè)進(jìn)化過(guò)程共篩選了超過(guò)105個(gè)菌落,測(cè)試了超過(guò)104個(gè)單克隆并測(cè)序了103個(gè)以上的突變體,最終獲得相對(duì)起始磷蛋白信號(hào)強(qiáng)度顯著提高的3個(gè)突變體LanMAMT-T65Acd(V29A/L66M/A117T)、LanMELE-T90Acd(A22E/F34L/A98E)、LanMLT-T114Acd(F34L/I115T)(圖3E)。
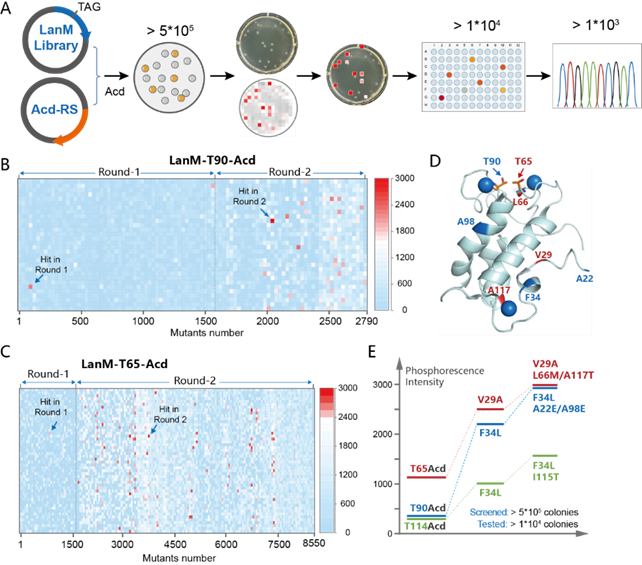
圖3 基于LanM的磷光蛋白的定向進(jìn)化
3. 敏化基團(tuán)的化學(xué)進(jìn)化
為進(jìn)一步提高磷光蛋白的信號(hào)強(qiáng)度,作者從兩個(gè)角度出發(fā),針對(duì)UAA的敏化基團(tuán)進(jìn)行設(shè)計(jì)和優(yōu)化。一方面,通過(guò)提高敏化劑的發(fā)射光譜與鑭系金屬吸收光譜的重疊程度,提高敏化基團(tuán)激發(fā)態(tài)到Eu金屬的能量轉(zhuǎn)移效率;另一方面,通過(guò)提高敏化基團(tuán)的三重態(tài)壽命提高其能量轉(zhuǎn)移效率。據(jù)此,作者設(shè)計(jì)了氟取代(FAcd)和硫取代(SAcd)的Acd同系物,其中氟原子具有強(qiáng)電負(fù)性,可通過(guò)誘導(dǎo)效應(yīng)改變分子內(nèi)的電子云分布,從而導(dǎo)致光譜紅移;而硫原子作為一種重原子,可通過(guò)增強(qiáng)敏化基團(tuán)的自旋軌道耦合作用提高敏化基團(tuán)在激發(fā)態(tài)時(shí)更容易發(fā)生系間竄躍,進(jìn)而提高三重激發(fā)態(tài)壽命。經(jīng)比較Acd、FAcd及SAcd的吸收光譜和發(fā)射光譜,F(xiàn)Acd光譜確有紅移;SAcd吸收光譜相對(duì)Acd強(qiáng),而發(fā)射光譜卻變?nèi)酰f(shuō)明其三重激發(fā)態(tài)占比可能更高(圖4A-C)。經(jīng)過(guò)氨酰tRNA合成酶篩選發(fā)現(xiàn)Acd-RS同樣可以高效識(shí)別FAcd和SAcd(圖4D-E)。將兩個(gè)非天然氨基酸引入LanMAMT-T65TAG和LanMELE-T90TAG后,發(fā)現(xiàn)FAcd的引入并未提高磷光信號(hào)強(qiáng)度,而SAcd因重原子效應(yīng)增加了激發(fā)態(tài)分子的系間竄躍效率,其插入LanM后磷光信號(hào)較Acd提升顯著(圖4G)。這一發(fā)現(xiàn)揭示了敏化基團(tuán)的熒光量子產(chǎn)率與能量轉(zhuǎn)移效率之間的反向關(guān)系:更高的熒光量子產(chǎn)率對(duì)應(yīng)于更少的三重態(tài)分子,可能導(dǎo)致能量轉(zhuǎn)移效率降低和磷光信號(hào)減弱。這一見(jiàn)解為未來(lái)的磷光蛋白進(jìn)化和優(yōu)化策略提供了寶貴的指導(dǎo)(圖4A-C)。
總之,作者通過(guò)戰(zhàn)略性地?fù)饺險(xiǎn)AA和優(yōu)化引入位點(diǎn),實(shí)現(xiàn)了鑭系金屬的敏化,使LanM蛋白的磷光增強(qiáng)了約十倍。隨后的定向進(jìn)化和敏化基團(tuán)的化學(xué)優(yōu)化進(jìn)一步提高了磷光信號(hào)強(qiáng)度,最終與野生型LanM相比實(shí)現(xiàn)了數(shù)百倍的增強(qiáng)(圖4H)。

圖4 磷光蛋白敏化劑的化學(xué)進(jìn)化
4. 磷光蛋白的光物理性質(zhì)表征
為明確磷光蛋白突變體的光物理性質(zhì),進(jìn)而分析其應(yīng)用潛力,作者接下來(lái)將與Affibody融合表達(dá)的LanM突變體(Af-LanM)純化出來(lái),測(cè)試了其磷光壽命和光譜。在保持穩(wěn)定結(jié)構(gòu)和高Eu3?結(jié)合能力的情況下,相同濃度的Af-LanMAMT-SAcd比Af-LanMAMT-Acd在615 nm處的熒光信號(hào)強(qiáng)度高約5倍(圖5B-C),而Af-LanMAMT-T65Acd/SAcd和Af-LanMELE-T90Acd/SAcd在615 nm處磷光壽命達(dá)500 μs(圖5D-E),說(shuō)明Eu3?的磷光信號(hào)強(qiáng)度因敏化基團(tuán)能量傳遞效率而異,但其磷光壽命并未受到敏化基團(tuán)干擾。經(jīng)磷光光譜測(cè)定,100 μs延遲后UAA的背景熒光完全消除,在100-1000 μs之間形成一個(gè)時(shí)間分辨的檢測(cè)窗口,對(duì)于接下來(lái)基于時(shí)間分辨檢測(cè)設(shè)計(jì)應(yīng)用場(chǎng)景提供了重要條件(圖5F-G)。
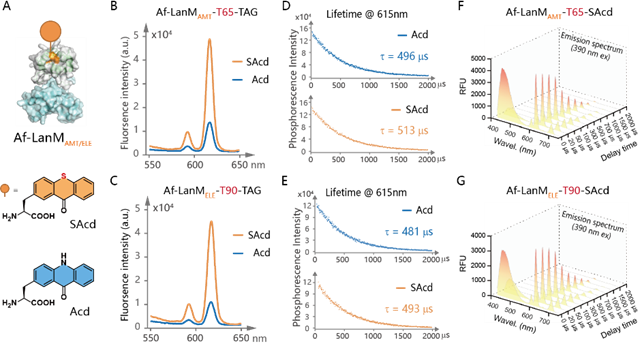
圖5 基于LanM的磷光蛋白突變體的光物理性質(zhì)
5. 生物傳感器開(kāi)發(fā)與應(yīng)用
作者基于其設(shè)計(jì)和進(jìn)化的長(zhǎng)熒光壽命(500 μs)、強(qiáng)Eu3?結(jié)合力、高磷光強(qiáng)度的磷光蛋白突變體,開(kāi)發(fā)了一個(gè)Eu3?檢測(cè)平臺(tái),其檢測(cè)限低于10 nM,對(duì)Eu3?的磷光響應(yīng)超過(guò)了其他鑭系金屬1000倍以上(圖6A-C)。
由于LanM的磷光依賴(lài)于正確的蛋白折疊和鑭系金屬的螯合,作者接下來(lái)通過(guò)向磷光蛋白突變體中插入蛋白酶識(shí)別序列(如TEV酶的ENLYFQS),開(kāi)發(fā)了一種蛋白酶活性檢測(cè)平臺(tái)(圖6D)。結(jié)果顯示,在P2位置插入蛋白酶識(shí)別序列在底物切割后磷光信號(hào)變化顯著,當(dāng)將該識(shí)別序列替換成Caspase-3(DEVD)和HRV 3C蛋白酶(LEVLFQGP)的識(shí)別序列時(shí),這些磷光蛋白底物在特定蛋白酶切割時(shí)顯示出顯著的磷光變化,表現(xiàn)出優(yōu)異的正交性,表明其作為序列特異性蛋白酶篩選平臺(tái)的潛力(圖6D-F)。
生物系統(tǒng)中的背景自發(fā)熒光對(duì)活細(xì)胞和體內(nèi)成像構(gòu)成了重大挑戰(zhàn)。長(zhǎng)壽命(微秒到毫秒)發(fā)光探針為所有基于發(fā)光的檢測(cè)提供了新的正交成像通道。基于LanM的磷光蛋白突變體具有長(zhǎng)激發(fā)波長(zhǎng)(390 nm)、長(zhǎng)發(fā)光壽命(500 μs)、紅光發(fā)射(615 nm)、大斯托克斯位移(~200 nm)和遺傳編碼能力,在生物成像中展現(xiàn)出較好的應(yīng)用潛力。雖然LanM-SAcd磷光蛋白探針需要對(duì)細(xì)胞進(jìn)行Eu3?染色,但Eu3?在50 μM濃度下的毒性可以忽略不計(jì)。此外,其獨(dú)特的發(fā)光機(jī)制保持了對(duì)靶標(biāo)蛋白標(biāo)記的高度選擇性,在細(xì)胞中遺傳標(biāo)記和金屬染色靶標(biāo)蛋白過(guò)程中,溶液中Eu3?由于吸收弱而產(chǎn)生極其微弱的背景磷光,而游離UAA由于壽命短而不產(chǎn)生磷光。磷光信號(hào)僅在同時(shí)含有UAA和螯合Eu3?的LanM突變體中觀(guān)察到,使得能夠在無(wú)需洗滌的條件下進(jìn)行選擇性標(biāo)記和成像。據(jù)此,作者將Af-LanM-SAcd作為免疫熒光二抗試劑,在HeLa細(xì)胞中成功實(shí)現(xiàn)PD-L1的雙通道成像(圖6G-H)。雖然傳統(tǒng)的共聚焦顯微鏡無(wú)法在615 nm處進(jìn)行長(zhǎng)壽命的時(shí)間分辨的成像,但這一技術(shù)在概念上可以通過(guò)超長(zhǎng)壽命通道實(shí)現(xiàn)多色成像,為細(xì)胞可視化建立了新的正交成像模式。
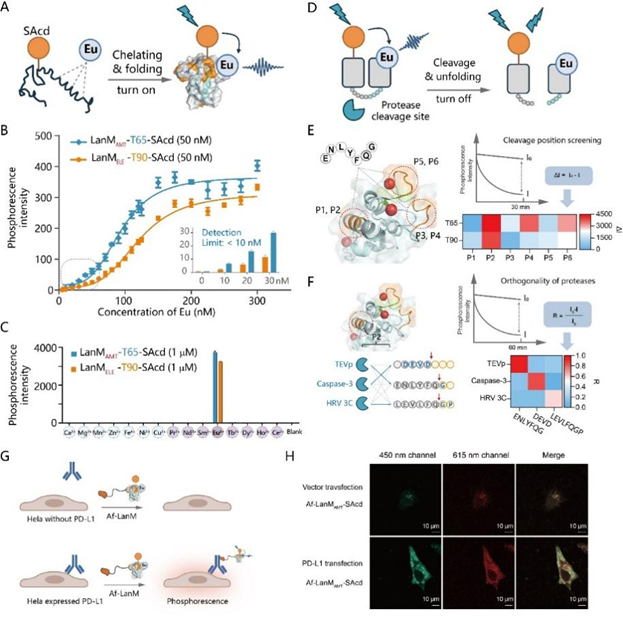
圖6 基于A(yíng)f-LanM-SAcd開(kāi)發(fā)的檢測(cè)和成像技術(shù)
結(jié)論
作者通過(guò)非天然氨基酸的引入和蛋白質(zhì)工程開(kāi)發(fā)了可遺傳編碼的磷光蛋白,其長(zhǎng)激發(fā)波長(zhǎng)、亞毫秒級(jí)磷光壽命、高信噪比和高選擇性的特性不僅能夠用于檢測(cè)鑭系元素,而且可用于構(gòu)建蛋白酶?jìng)鞲衅骱兔庀闯上裉结槨T谖磥?lái)的研究進(jìn)程中,通過(guò)擴(kuò)展底物范圍、優(yōu)化穩(wěn)定性和表達(dá)系統(tǒng),磷光蛋白有望在藥物發(fā)現(xiàn)、時(shí)間分辨成像和酶活性監(jiān)測(cè)等領(lǐng)域發(fā)揮重要作用。
本文的通訊作者為南方科技大學(xué)化學(xué)系王杰副教授。南方科技大學(xué)化學(xué)系博士生王金玉為第一作者,課題組成員劉行峰、李開(kāi)通、彭甜甜、石桃、許倩倩、黃清俊、高子奇為共同作者,陸為教授及其團(tuán)隊(duì)成員周洪齊博士亦為本研究做出了貢獻(xiàn)。該工作得到了國(guó)家自然科學(xué)基金委、科技部國(guó)家重點(diǎn)研發(fā)計(jì)劃、北京分子科學(xué)國(guó)家研究中心、深圳市科創(chuàng)委、深圳市醫(yī)學(xué)科院等項(xiàng)目的支持。
原文鏈接:https://pubs.acs.org/doi/10.1021/jacs.5c00199








