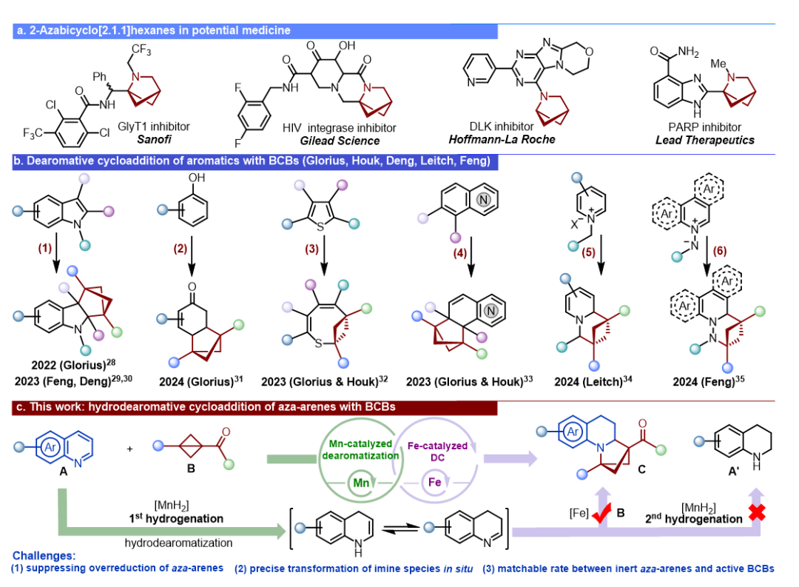
平面六元氮雜芳烴(如吡啶、喹啉等)廣泛存在于天然產物和藥物分子中,但芳基化合物在體內可能產生毒性代謝產物。將這類分子轉化為富含C(sp3)的三維結構(如aza-BCHs,scheme 1a),可顯著改善其理化性質和生物活性,提升其藥效和安全性。然而,現有芳基化合物去芳構化結合雙環丁烷(BCBs)的方法多依賴貴金屬催化劑、光誘導或預活化策略,存在成本高、選擇性差或步驟繁瑣等問題(scheme 1b)。因此,開發非貴金屬催化體系,實現氮雜芳烴的去芳構化并從平面轉化為三維結構具有重要價值。 氮雜芳烴的催化還原是一個串聯過程,可以產生多種活性還原中間體。如何避免氮雜芳烴過度還原,對單一中間體進行精準捕獲與選擇性轉化是本研究面臨的關鍵挑戰。針對這一問題,作者通過開發可調控還原動力學的Mn/Fe廉價雙金屬催化體系,成功實現了氮雜芳烴原位生成亞胺與雙環丁烷環之間的環加成反應,為新型2-氮雜雙環[2.1.1]己烷類三維分子的構建提供了有效方法(scheme 1c)。
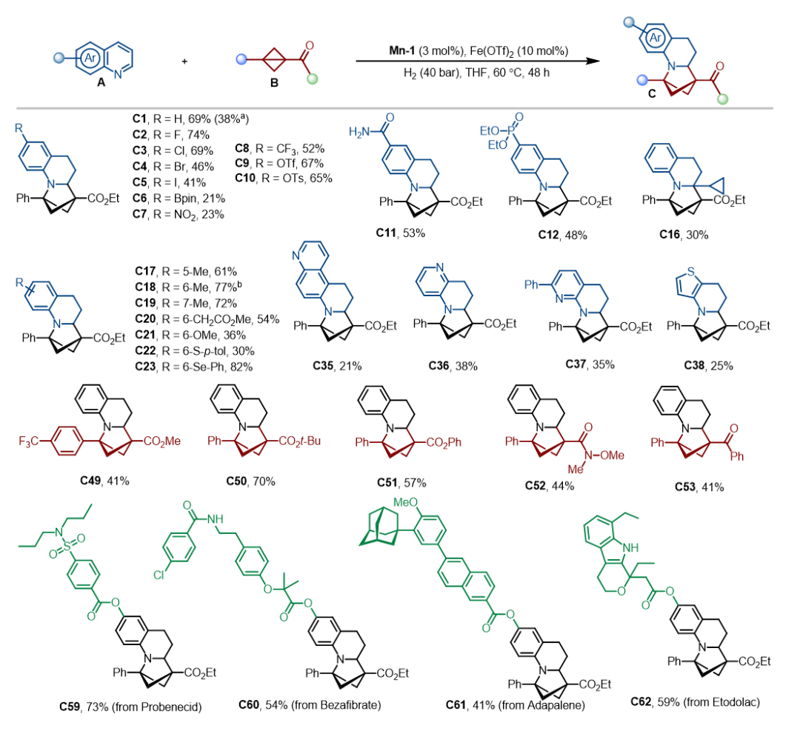
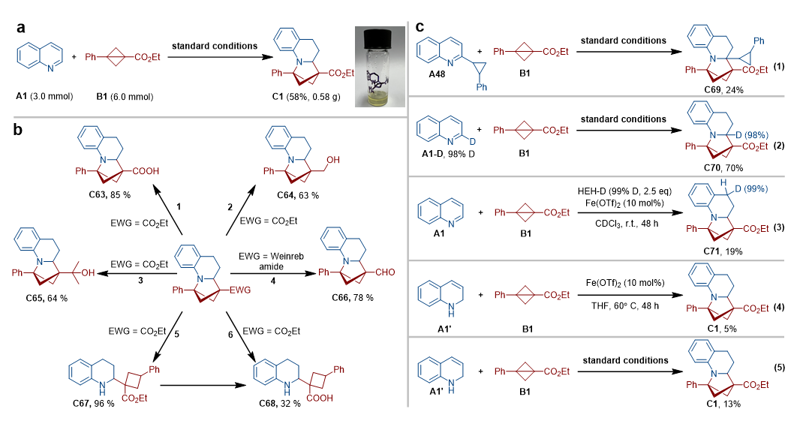
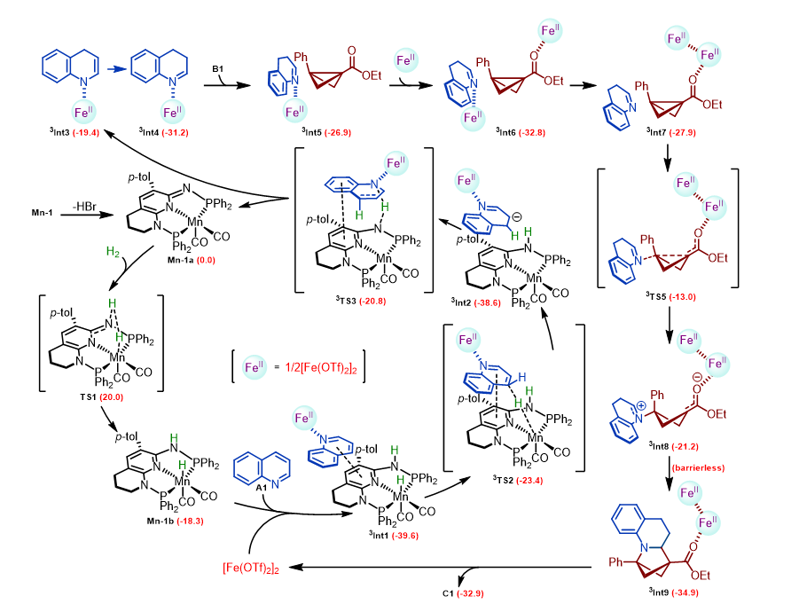
Scheme 1. a: 含有2-氮雜雙環[2.1.1]己烷的代表性生物醫學分子。b: 芳烴與BCBs的去芳構化環加成。c: 雜氮芳烴與BCBs的去芳構化環加成(本研究)。DC:偶極環加成。 作者選定喹啉A1與雙環丁烷B1作為模板底物進行了系列條件優化,并根據最優反應條件進行了底物拓展,驗證了該反應優異的官能團兼容性。同時,作者也合成了一些引入藥物分子片段的喹啉,并成功將其轉化為稠合雙環丁烷類三維結構分子,揭示了該反應在藥物分子衍生化中的潛在價值(Figure 1)。 Figure 1. 部分代表性底物示例。 作者對產物進行了多種轉化,包括放大實驗以及合成了多個含有功能性基團的三維分子結構。此外,作者也開展了系列控制實驗以進行機理研究。通過自由基鐘實驗排除了自由基機理,通過氘代實驗以及1,2-二氫喹啉作為底物的控制實驗排除了氮雜芳烴進行1,2氫化去芳構化的模式,通過氘代漢斯酯(deuterated Hantzsch Ester,HEH-D)等實驗驗證了氮雜環的還原去芳構化始于氮雜環的4號位(Figure 2)。 Figure 2. a: 放大實驗。b: 產物衍生化。c: 控制實驗。 作者結合DFT理論計算,證明了1,4-加氫產生的烯胺經互變異構成亞胺的能壘相比直接3,4-氫化能壘要低7.4 kcal/mol,進一步驗證了反應是經歷了1,4-氫化機理(Figure 3)。 Figure 3. 反應機理的DFT計算(kcal/mol)。 華南理工大學張珉和汕頭大學倪紹飛聯合報道了一例具有高原子經濟性、步驟高效的通過氮雜芳烴的氫化去芳構化[2π+2σ]環加成反應合成2-氮雜雙環[2.1.1]己烷的新方法。該策略合成了一類新型吡咯烷生物電子等排體,在藥物合成及衍生化方面具有重要應用前景。 論文信息 Direct Access to Functional 2-Azabicyclo[2.1.1]Hexanes via Hydrodearomative [2π + 2σ] Cycloaddition of Aza-Arenes Jian Yang, Bo-Xuan Yao, Huan-Feng Jiang, Shao-Fei Ni Pierre H. Dixneuf, Min Zhang Angewandte Chemie International Edition DOI: 10.1002/anie.202505060