脂肪胺及其衍生物廣泛存在于生物及藥物活性分子中。飽和氮雜環骨架(如哌啶和吡咯烷)也廣泛應用于藥物開發中。因此,發展有效合成脂肪胺及其衍生物的催化方法具有重要的意義。近年來,脂肪胺中α-C-H鍵的烷基化反應已成為構建C-N鍵的有效方法,但該策略需要經N-保護、催化的C-H烷基化或芳基化以及隨后的N-脫保護才能實現伯胺的α-C-H鍵官能化。除此之外,三氟酰胺基或苯甲酰胺基的脫除條件非常苛刻。僅Rovis課題組經CO2原位保護實現了脂肪伯胺的催化α-C-H烷基化反應,并得到了γ-內酰胺產物(Figure 1A)。目前仍缺少未保護伯胺經C-H官能化以合成α-叔碳伯胺的有效方法。近日,英國巴斯大學Alexander J. Cresswell課題組解決了上述問題,他們基于光催化的策略,將伯胺1催化生成未受保護的α-氨基自由基2,其經親電Michael受體3捕獲制備了一系列α-叔胺衍生物或具有藥理價值的γ-內酰胺(Figure 1B)。相關研究成果發表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.202005294)。
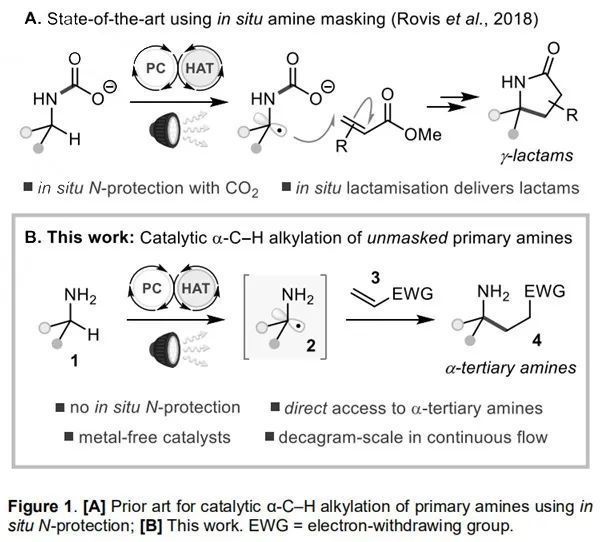
(來源:Angew. Chem.Int. Ed.)
首先作者以環己胺5和丙烯酸丁酯6為模型底物進行研究(Figure 2)。在藍光LED燈光照射下,通過對各種光催化劑(PCs)和氫原子轉移催化劑(HAT)的篩選,作者發現以4CzIPN為光催化劑,四丁基疊氮銨(Bu4N+N3-)為HAT催化劑(Ep/2 of N3-= +0.87 V vs SCE in MeCN),底物5和6在乙腈中順利進行α-C-H烷基化反應,并以85%的NMR收率得到產物7(Figure 2,entry 1)。控制實驗表明,4CzIPN、可見光源和疊氮催化劑都是反應所必需的。
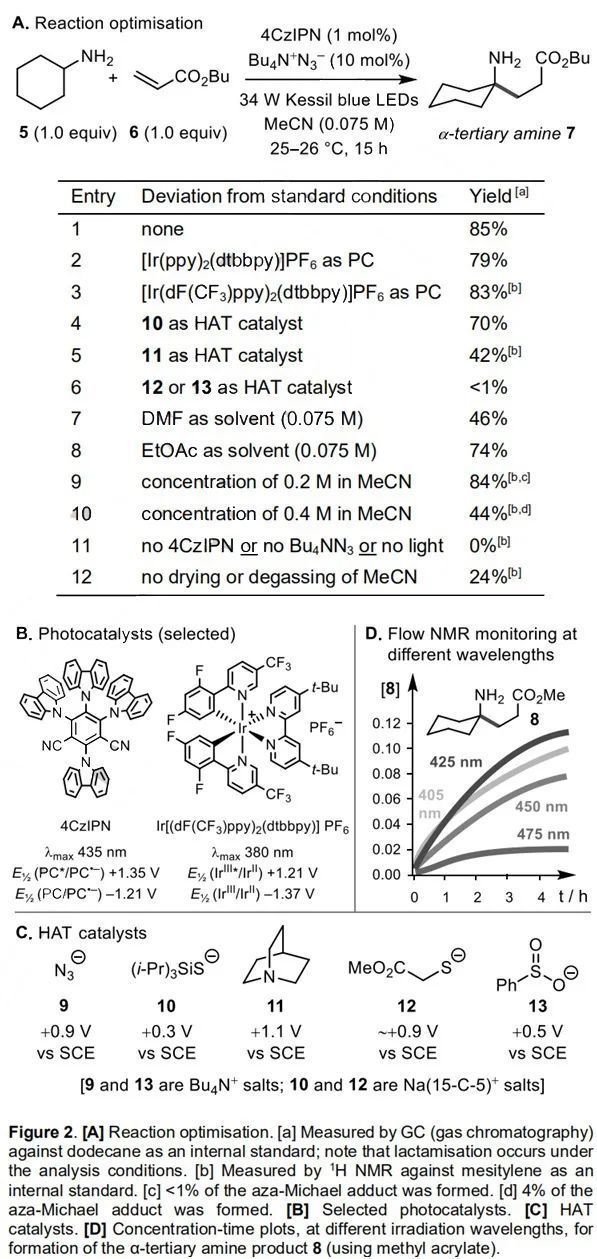
(來源:Angew. Chem.Int. Ed.)
接著,在最優條件下,作者研究了伯胺1的反應范圍(Figure 3A)。由于最初形成的γ-氨基酯16容易在加熱時發生內酰胺化,因此作者選擇將它們繼續轉化為γ-內酰胺17。4-7元環狀的伯胺可以良好的收率得到氮雜螺環(17a-17d,17k-17u)。多種官能團如縮醛、羥基、砜和酯基等都具有良好的耐受性。另外,該反應體系也可以兼容一系列非環狀的伯胺(17e-17j,17v-17x),收率適中。此外,在該反應體系下,含有兩個α-C-H鍵的伯胺1f,y-ab首次發生了α-C-H雙烷基化反應,直接生成α-叔碳胺19。其繼續經內酰胺化以27%–55%的收率得到γ-內酰胺20(Figure 3C)。作者還考察了單烷基化的烯烴受體的適用范圍(Figure 3D)。連有α-或β-取代基的丙烯酸酯21a-21e均是耐受的。乙烯基吡啶21h、21i也能得到目標了α-烷基化產物。
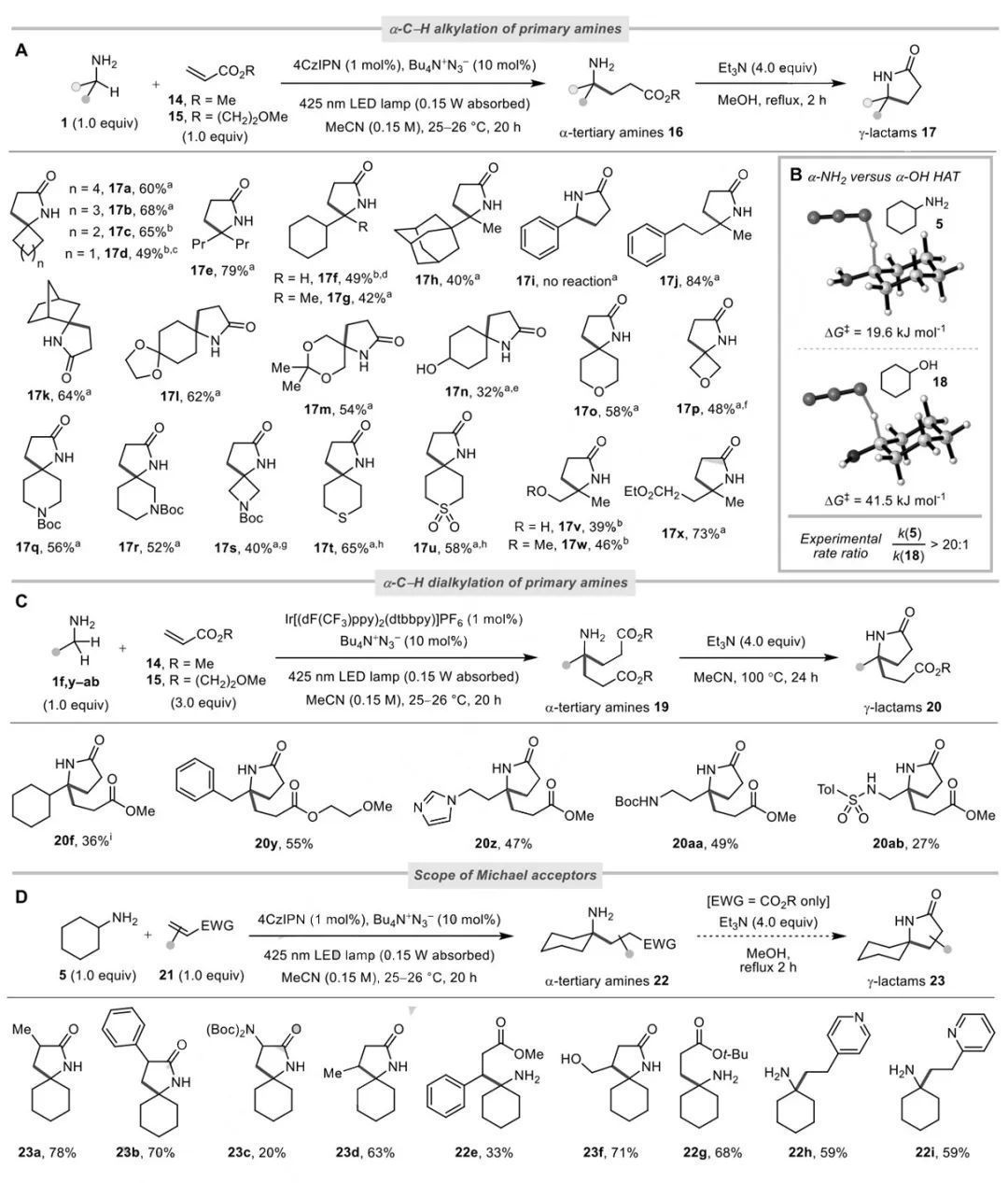
(來源:Angew. Chem.Int. Ed.)
為證實該反應在快速和模塊化組裝α-叔碳胺衍生物的實用性,作者利用連續流對γ-氨基酯產物進行了一系列N-官能化,并制備了一系列α-叔碳胺衍生物24a-24f。環己胺5與丙烯酸甲酯14在連續流中可以十克規模進行反應,每次能分離得到10.1克產物17b。
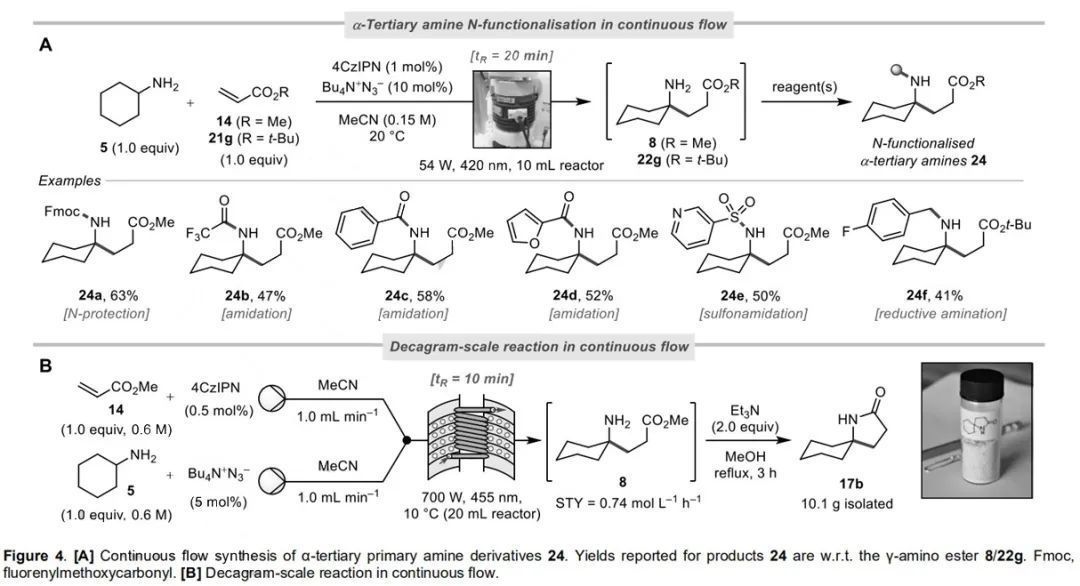
(來源:Angew. Chem.Int. Ed.)
最后,作者提出了一個合理的催化循環(Figure 5A)。起初,疊氮離子經光激發的4CzIPN氧化產生疊氮自由基,N3?是一種強氧化劑,其甚至可以拔掉未活化烷烴中的氫原子。隨后,伯胺中較弱的α-C-H鍵選擇性地發生HAT,所得的α-氨基自由基25快速地與丙烯酸酯受體加成得到α-羧基穩定的自由基26。該自由基被[4CzIPN] ?–自由基陰離子還原為相應的烯酸酯27,然后經HN3質子轉移生成γ-氨基酯產物,并再生疊氮離子。
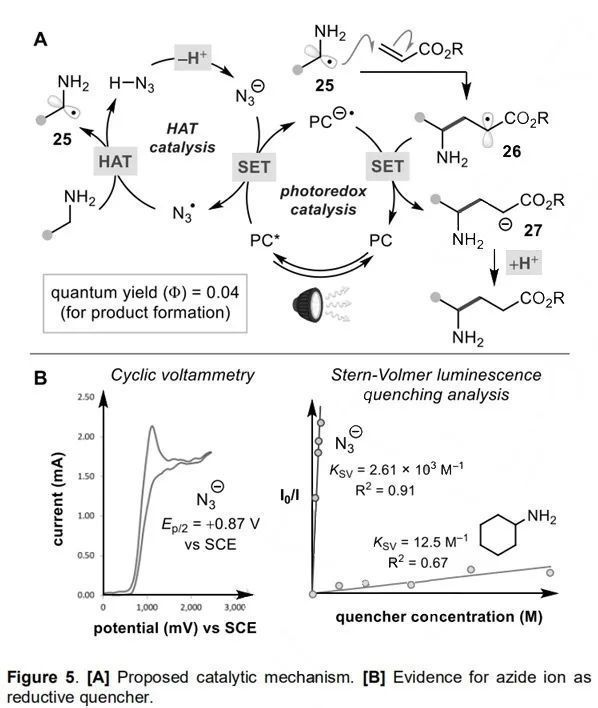
(來源:Angew. Chem.Int. Ed.)
總而言之,作者發展了首例可見光照射下光催化的脂肪族伯胺與親電子烯烴的α-C-H烷基化反應。該雙催化體系利用疊氮陰離子作為HAT催化劑,并且能以十克規模制備一系列α-叔碳胺和氮雜(螺)環合成砌塊。










