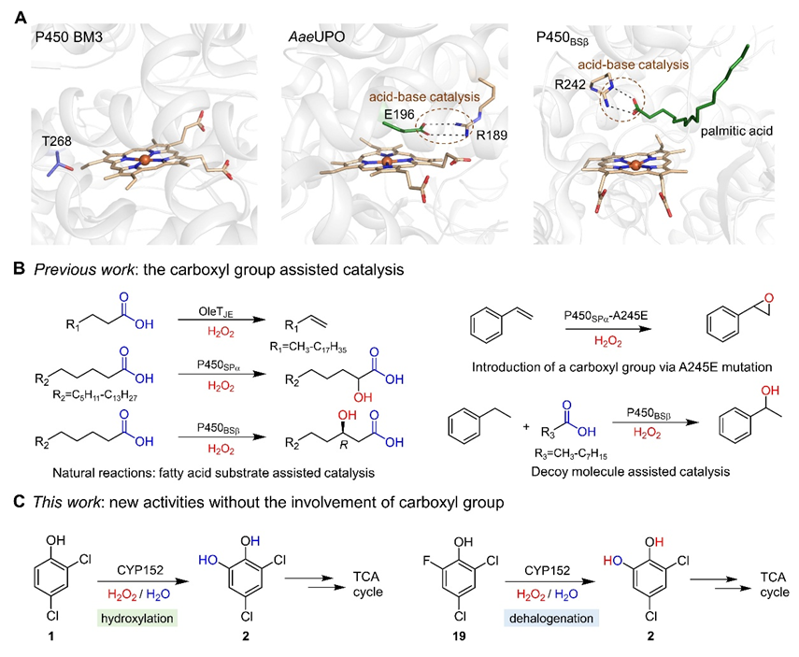
探索酶的催化混雜性是酶學領域的重要前沿方向。細胞色素P450酶作為自然界催化多樣性最高的生物催化劑,在催化有機化合物中多種C-H鍵的氧官能化反應中表現出色。然而,其體外酶反應往往受限于對昂貴輔酶NAD(P)H的依賴以及復雜的電子傳遞網絡。相比之下,P450過加氧酶(如CYP152過加氧酶)僅需過氧化氫作為輔因子,可在溫和條件下選擇性氧化有機分子,展現出更廣闊的應用前景。 在過去的幾十年里,這類P450酶的獨特性質引發了酶學領域的廣泛關注。盡管P450過加氧酶的底物范圍和催化多樣性通過酶工程改造已獲得顯著提升,但傳統觀點認為其催化活性高度依賴活性位點中羧基官能團通過胍基-羧基配對形成的特異性酶-底物相互作用來激活過氧化氫以生成必要的高反應活性中間體。這一機制導致其底物譜局限于含羧基化合物,如何拓寬該家族酶的底物范圍具有重要的基礎研究意義和實際應用價值。
近日,山東大學李盛英教授、高翔教授和南京師范大學黃和院士合作,首次發現CYP152過加氧酶能夠識別2,4-二氯苯酚這一不含羧基基團的底物,并催化鄰位羥基化反應。該發現挑戰了血紅素依賴性H2O2利用酶需要活性位點內的羧基通過酸堿催化激活H2O2的傳統認知,同時解鎖了該類酶對多種芳烴環境污染物的羥化和脫鹵新活性。 進一步通過構效關系分析、底物通道重塑及關鍵催化基團突變等實驗,揭示了CYP152過加氧酶對鹵代酚、硝基酚和氰基酚等多類型不含羧基的芳烴環境污染物的羥化及脫鹵新活性。結合晶體結構分析、同位素18O示蹤實驗、分子動力學模擬及量子力學/分子力學計算,闡明了鹵素基團激活底物酚羥基,促進關鍵催化中間體Compound I的形成,且產物中新生成的羥基來源于水,繞過了經典氧反彈步驟。這一發現首次揭示了P450過加氧酶對非羧酸底物的質子偶聯電子轉移新機制,拓展了生物催化C-H鍵活化和C-鹵鍵斷裂的反應邊界。 該工作為利用P450過加氧酶開展環境修復與污染控制開辟了新思路,而且所構建的簡單、高效酶催化體系在降解苯酚類污染物方面展現出巨大的應用潛力,有望推動綠色生物催化技術的可持續發展。 論文信息 Unexpected Activities of CYP152 Peroxygenases towards Non-carboxylic Substrates Reveal Novel Substrate Recognition Mechanism and Catalytic Versatility Yuanyuan Jiang, Piqian Gong, Zijia Li, Zhong Li, Yuxuan Li, Binju Wang, He Huang, Wei Peng, Xiang Gao, Shengying Li Angewandte Chemie International Edition DOI: 10.1002/anie.202506614