與傳統(tǒng)癌癥治療中凋亡途徑易受耐藥性影響不同,癌細(xì)胞為適應(yīng)快速增殖所需的能量代謝異常,反而暴露出對(duì)鐵死亡的高度敏感性。這種代謝重編程導(dǎo)致細(xì)胞內(nèi)多不飽和脂肪酸蓄積、鐵離子失衡,使乳腺癌、腎癌等惡性腫瘤的抗氧化防御系統(tǒng)出現(xiàn)漏洞。然而,腫瘤微環(huán)境的復(fù)雜特性使得單一治療手段難以奏效,亟需開發(fā)能協(xié)同多重細(xì)胞死亡機(jī)制的新型療法。近日,中科院長春應(yīng)化所及南開大學(xué)安尚杰、姜秀娥等人開發(fā)了一種新型納米顆粒(VAP NPs),通過釩酸鹽與金精三羧酸(ATA)的配位作用合成。該顆粒在腫瘤微環(huán)境中表現(xiàn)出雙重活性:在酸性過氧化氫(H2O2)條件下,VAP NPs通過Russell機(jī)制生成高毒性的單線態(tài)氧(1O2),同時(shí)通過類Fenton反應(yīng)產(chǎn)生羥基自由基(?OH)。
這種納米平臺(tái)利用雙重Russell機(jī)制和Fenton反應(yīng)在腫瘤微環(huán)境中產(chǎn)生單線態(tài)氧(1O2)/羥基自由基(?OH),同時(shí)通過釩的氧化還原循環(huán)消耗谷胱甘肽(GSH),從而沉默谷胱甘肽過氧化物酶4 (GPX4)并調(diào)節(jié)Kelch樣ECH相關(guān)蛋白1(KEAP1)/核因子紅系2相關(guān)因子2(NRF2)/血紅素加氧酶1(HMOX1)軸。

研究還揭示了腫瘤微環(huán)境中ATP分子的新角色。腫瘤微環(huán)境中高濃度的ATP不僅增強(qiáng)VAP NPs的ROS產(chǎn)生并且通過雙重作用誘導(dǎo)VAP NPs的聚集,包括磷酸和釩酸鹽的配位以及含N堿基和ATA作用。在增強(qiáng)ROS產(chǎn)生的過程中,ATP磷酸基團(tuán)和釩酸鹽之間的配位相互作用可以有效地調(diào)節(jié)局部H2O的取向,促進(jìn)ATP、VAP NPs和H2O之間形成強(qiáng)氫鍵網(wǎng)絡(luò)并增強(qiáng)了ROS產(chǎn)生中的質(zhì)子和電子轉(zhuǎn)移過程。
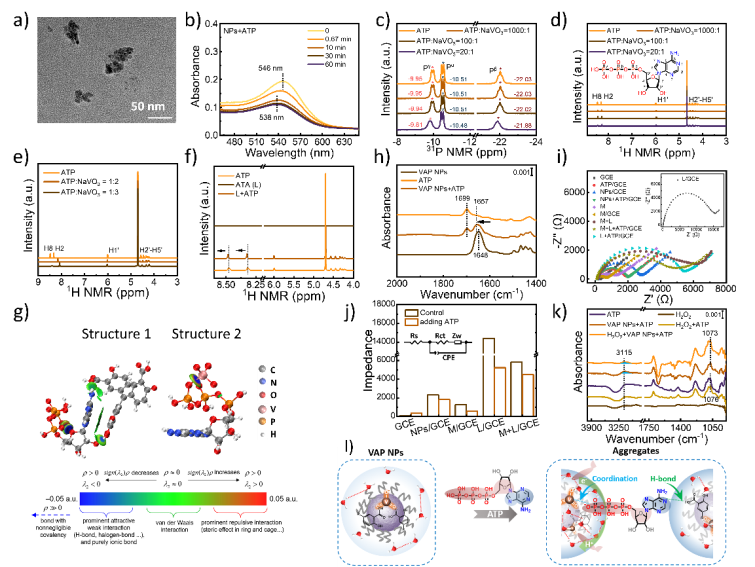
基于這些發(fā)現(xiàn),VAP NPs在體外和體內(nèi)實(shí)驗(yàn)都表現(xiàn)出良好的抗腫瘤效果,并且聯(lián)合ATP進(jìn)一步增強(qiáng)了治療效果。總的來說,這一策略為基于Russell/Fenton的納米療法提供了思路,同時(shí)揭示了ATP增強(qiáng)的局部氧化還原調(diào)控功能。
論文信息
ATP-Assisted Electron and Proton Transfer Boosting Redox Metabolism-Induced Ferroptosis and Apoptosis for Cancer Therapy
Shangjie An, Wenyao Zhen, Yue Wang, Xiaodan Jia, Xiue Jiang
Angewandte Chemie International Edition
DOI: 10.1002/anie.202504542








