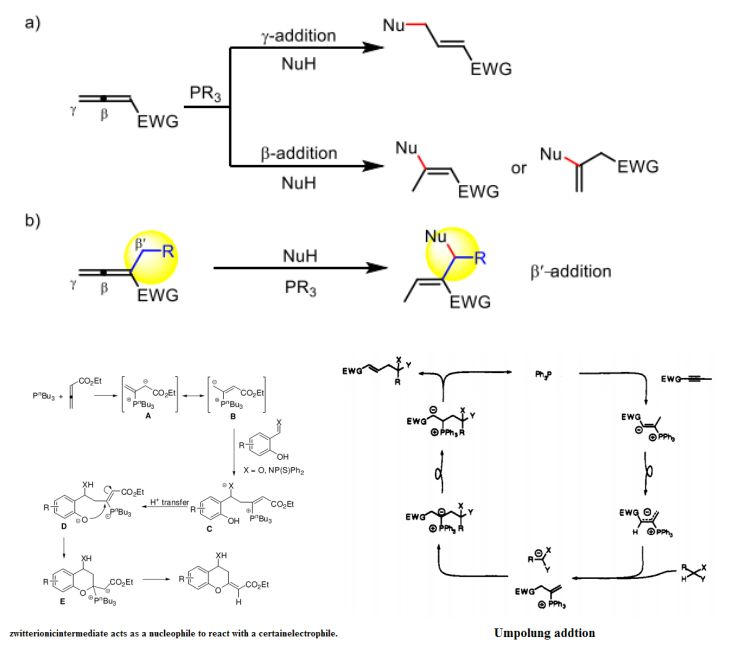
在過去的幾十年中,膦催化的反應受到了廣泛的關注,因為它們為有機合成中形成各種C-C鍵提供了強有力的,無金屬的途徑,消除了有機產品中金屬的污染。在眾多膦催化的反應中,在這一領域的貢獻集中在親電加成上,其中原位形成的兩性離子中間體充當親核試劑與特定的親電試劑反應。(Chem. Soc. Rev., 2014, 43, 2927--2940)之后膦催化的親核加成反應被發現,為C-C鍵的構成增加了一種新途徑,20世紀90年代,Trost 和Lu報道了一種由翻轉加成反應,此類反應中,兩性離子中間體作為前親核試劑拔去真正的親核試劑的H使之變為親核試劑,反過來被親核試劑進攻 。有科學家報道了新型聯烯的β-加成反應,但是這類反應種類較少需要拓寬反應產物種類,2009年,有科學家發現了γ-甲基取代的聯烯甲酸酯,發現了δ-碳的反應新位點一次設計了一系列的環化反應,比如聯烯酸酯[3+3]/[3+3]的環化反應,但是在ε位點反應的類型還很少。
二烯羧酸酯不僅是有機合成中一類重要的合成子,而且廣泛存在于許多天然產物中,比如抗細菌抗生素Macrolactin A,抗真菌抗生素(+)-papulacandin D等等。
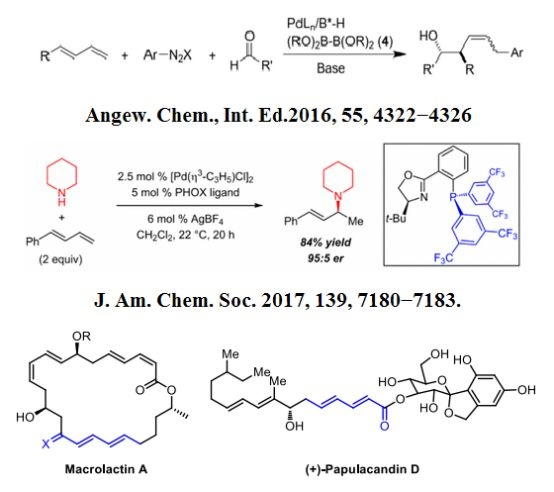
盡管目前存在合成二烯羧酸酯的方法有很多,包括過渡金屬催化的偶聯反應,Witting反應,聯烯的異構化反應,等等,但是他們都存在著一些確點,比如過渡金屬會對環境造成污染,大量的副產物,有些需要很長的合成步驟,因此,開發一種可以無金屬,高效,簡單的合成二烯羧酸酯方法,成為了目前方法學研究的焦點。
基于此背景,南開大學化學學院國家重點實驗室和元素有機化學研究所的黃有課題組發表了一篇膦催化的乙烯基聯烯酯的遠程1,7-加成合成二烯羧酸酯的文章,此文章的作者是馮佳旭(第一作者)和黃有(通訊作者)。(ACS Catal. 2020, 10, 3541?3547)
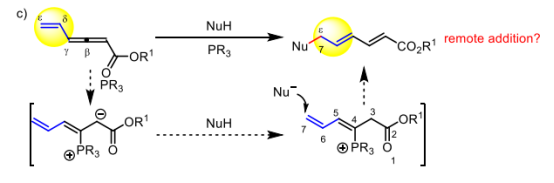
作者首先設計了該反應,在聯烯酯的γ位置上加入了一個乙烯基,延伸了該底物的π電子體系,從而構建了一個二烯二烯體系。
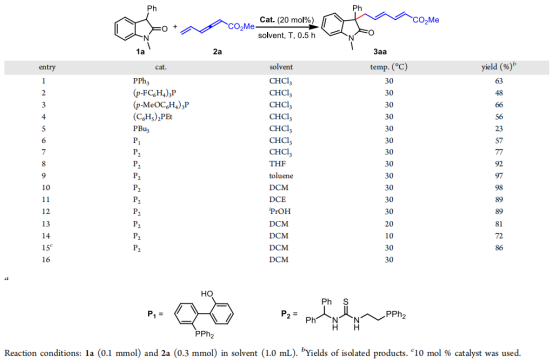
作者使用1-甲基-3-苯基吲哚-2-酮,乙烯基聯烯甲酸甲酯作為模板底物嘗試了反應,用氯仿做溶劑,30℃條件下使用PPh3以及其他膦催化劑取得了很好的反應,產率有48-63%(條目1-3),說明此反應可行,作者使用了強親和性催化劑乙基二苯基膦得到了56%,又換用了其他強親核性的膦比如三丁基膦,產率反而降了(條目4-5),于是作者設想使用含有額外官能團的雙功能膦來提高反應性,膦與底物之間的額外相互作用可以加速反應速率,根據這一想法使用了硫脲衍生的膦P2得到了最佳產率(77%,條目7),接著作者篩選出使用DCM為最佳溶劑,30℃為最佳反應溫度,催化劑的使用量為20 mol%(條目10)。
作者使用此最佳反應條件對底物進行了拓展,首先是不同親核試劑和乙烯基聯烯甲酸酯的反應,在使用吲哚-2-酮類化合物時,3號位上為不同取代基時(3a-3m),都有很好的耐受性,只有苯環上3,5位上為甲氧基時,產率下降為69%,5號位上為給電子基團時產率達99%,相反為吸電子基團時,產率下降為79%,說明電子效應對共軛苯環影響較大,接著探究了1號位上用叔丁氧羰基保護的底物的反應性,都得到了目標產物(3n,3o),還探究了酯的不同,都得到了良好的產物(3r,3s),另外作者使用了各種1,3-二羰基化合物作為親核試劑,都得到了目標產物,值得注意的是,使用含有兩個α-H的乙酰乙酸甲酯時(3w),得到了雙加成的產物,產率有29%,另外環裝1,3-二羰基化合物和線型親核試劑也兼容(3t-3y)。
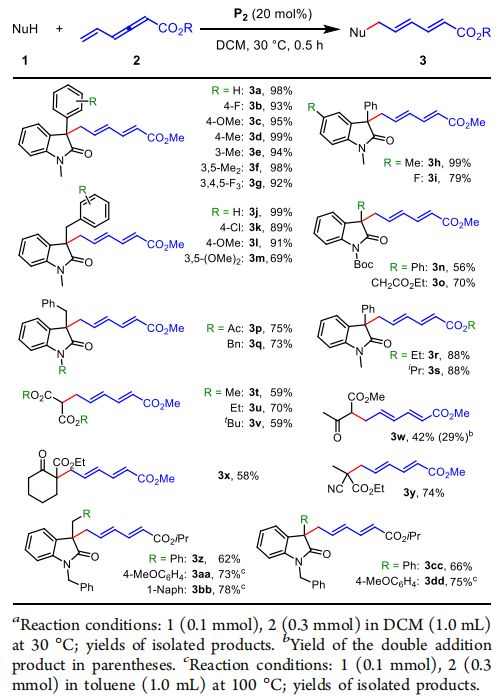
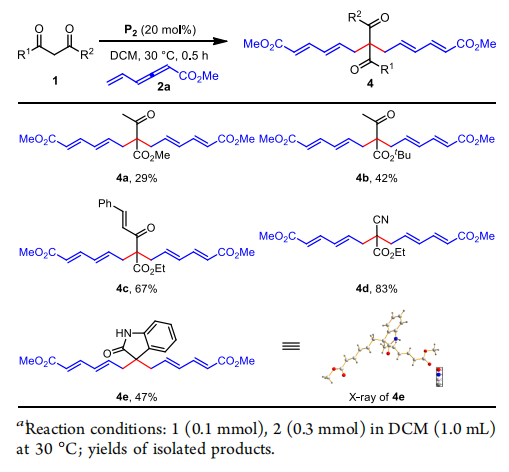
由3w得到的產物,作者繼續探究了雙加成產物的底物范圍,由于不穩定性,這類化合不容易被其他方法制備,令人高興的是,乙酰基乙酸叔丁酯,苯基烯丙酰基乙酸乙酯,氰基乙酸乙酯(4b-4d)都得到了預期的產物,吲哚-2-酮也得到了47%的收率(4e),X射線單晶分析證明了產物的結構。
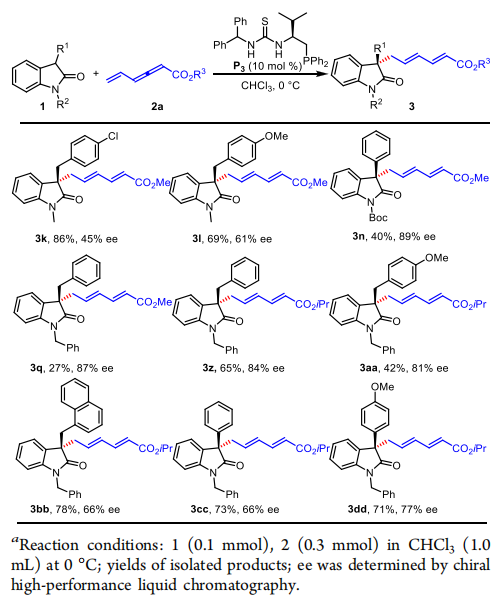
作者在使用手性的硫脲衍生物配體P3時,得到的產物同樣是有手性的,作者列舉了幾類產物并測得ee值在45%-89%。
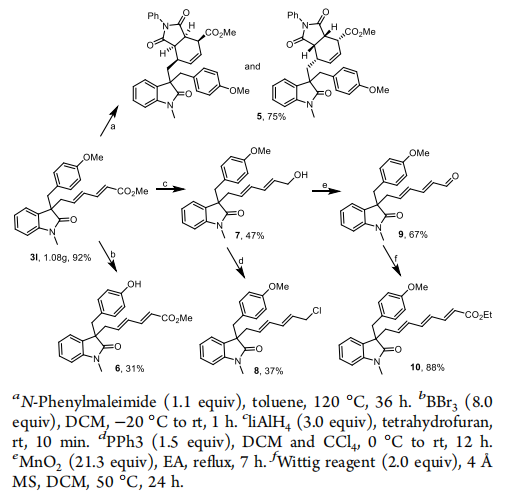
作者做了一系列應用試驗,來檢驗產物的有用性,首先成功進行了做了放大試驗(
1.08 g),接著作者用產物3l為底物做了應用試驗,包括D-A反應,脫甲基反應,酯的還原反應,Witting反應等,都成功的得到了目標產物。
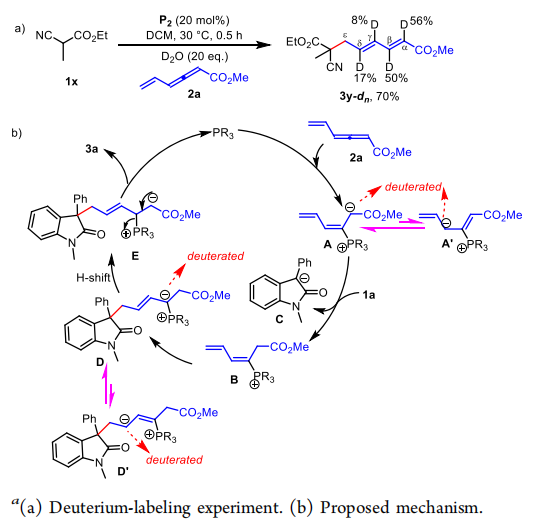
作者根據之前的文獻中的翻轉親核加成反應的機理,以及生成產物構型,提出了以下機理,首先是膦催化劑進攻β位置形成一個兩性離子中間體,由于π電子共軛體系的穩定性,中間體A的穩定性>A’的穩定性,隨后作者通過氘代實驗證明了此結論α(56%)>γ(8%),接著兩性離子中間體作為強親核試劑拔去親核試劑的氫得到C,親核試劑C親核進攻遠端ε位置形成兩種兩性離子D,D’,P正離子吸電子能力更強,隨后氘代實驗證明δ(17%)<β(50%),在經過一個H轉移得到中間體E,最后脫去膦催化劑得到最終產物。作者在最后使用1x為底物,做了氘代實驗得到的α(56%):β(50%):γ(8%):δ(17%),與作者推斷相符。
綜上,作者使用一種硫脲衍生的膦催化劑完成了乙烯基聯烯酯的遠程1,7-加成反應,該反應克服了難以控制反應位點的難題,親核加成在了ε位置上,反應底物適用性好,產率高,克服了遠程加成立體選擇性難以控制的難題,得到了較好的ee值,同時也實現了雙親核加成的產物的合成,得到的二烯類化合物得到了良好的應用,為以后在藥物化學,材料化學等領域的合成做出了貢獻。
Phosphine-Catalyzed Remote 1,7-Addition for Synthesis of DieneCarboxylates
DOI:10.1021/acscatal.0c00588








