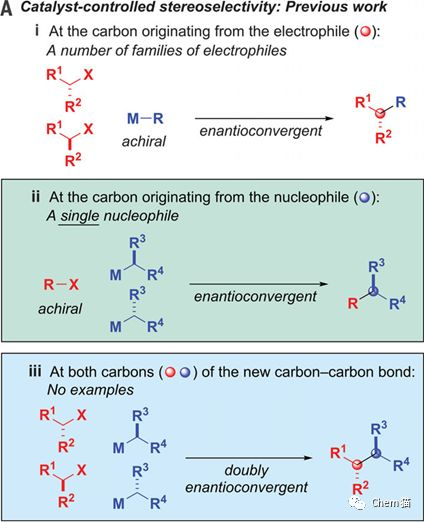
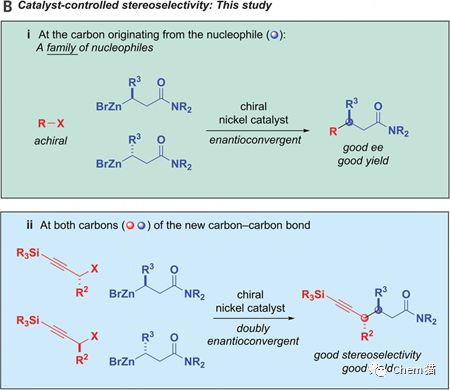
在有機合成中,由親核試劑和親電試劑發生反應構建碳碳鍵的親核取代反應是最簡單的反應之一。但是,它的立體化學控制一直是難點,而且底物范圍不寬泛,副反應多。迄今,單一反應原料的立體控制也有報道,而二分子的外消旋體原料的立體控制尚未報道。
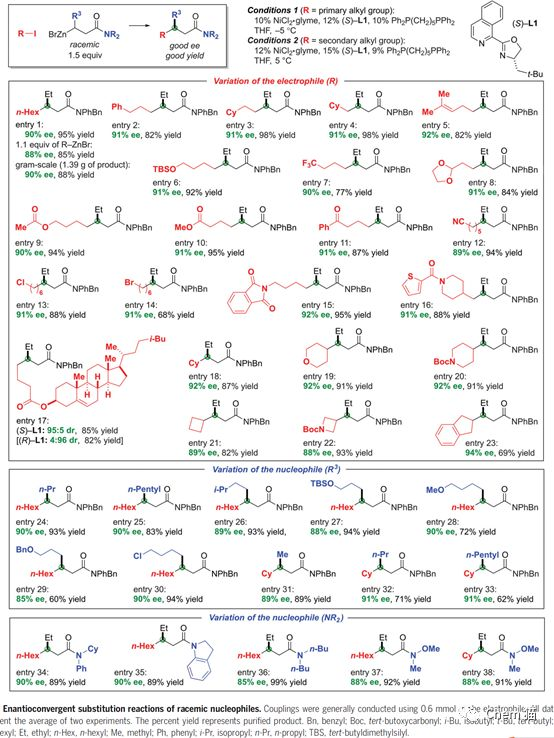
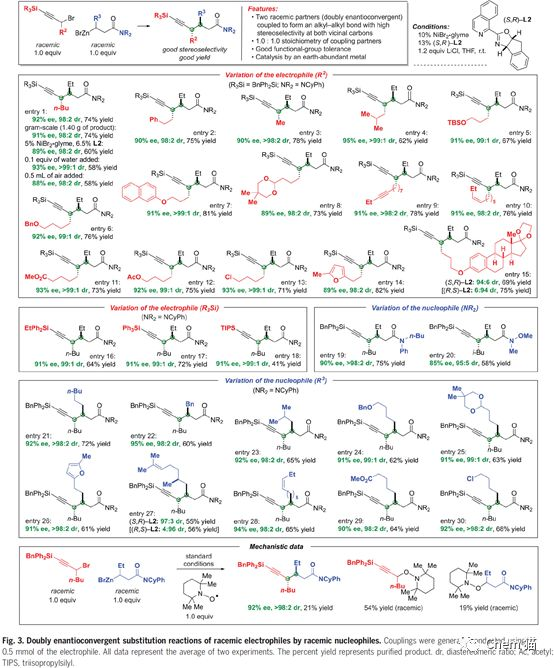
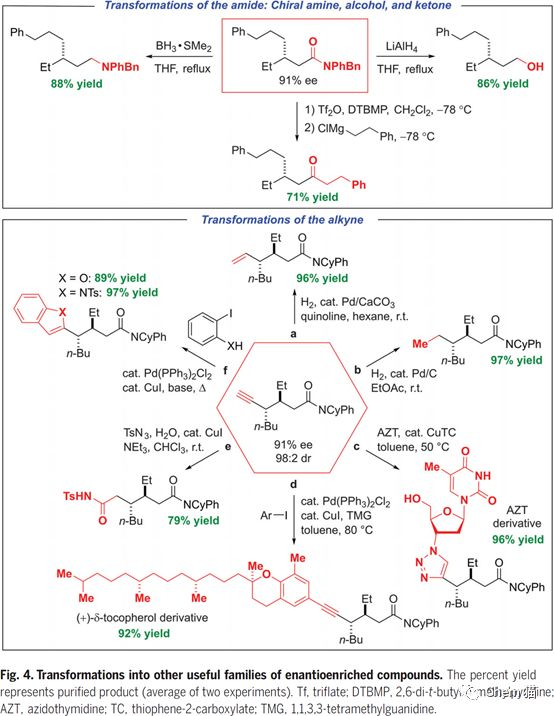
目前,過渡金屬催化的芳基與芳基偶聯構建碳碳鍵的反應已經得到了很大的發展,給有機合成和藥物分子合成帶來了極大的便利。最近,加州理工學院的Gregory C. Fu教授他們證明了過渡金屬,尤其是地球上含量豐富的鎳,可以催化烷基親電試劑的親核取代反應,并且解決了反應選擇性和立體選擇性較差的問題。 在反應研究的初期,作者使用烷基碘試劑和烷基鋅試劑作為原料,金屬鎳和雙氮配體的催化體系,得到了目標產物。進一步,通過配體篩選,優化反應的對映選擇性。最終,在較優條件下,模板反應得到了90% ee值,95%的收率。隨后,篩選了一系列的一級烷基碘代物,例如苯基,酯基,烯基,縮酮,酰胺,氰基等碘代物,都能得到優異的收率和對應選擇性。同樣,也拓展了烷基鋅試劑,長鏈,酯基,氯代,肟類,醚類的烷基鋅試劑都有較好的結果。 接下來,作者嘗試了二級的氯代烷烴與烷基鋅試劑反應。由于有兩個手性中心需要調控,這無疑是更大的挑戰。通過配體的設計與優化,成功的實現了高立體選擇性和反應性的烷基化反應。在底物范圍考察階段,作者嘗試了多種烷基鹵代試劑,都得到很好的結果,同樣,各種烷基鋅試劑也進行了考察并得到優異的收率和立體選擇性。 進一步,作者對反應產物進行了衍生實驗,酰胺的烷基化和還原,都能順利的進行,得到較高收率的產物。還能發生sonagashira偶聯反應,Pd/C還原反應等等。 總的來說,作者成功地實現了對于外消旋原料的不對稱親核取代反應,方便、簡潔的構建碳碳鍵,得到專一異構體的產物。機理方面也特別有意思,需要進一步研究。但底物范圍也不是很廣,只有炔烴的鹵代物和酰胺類的鋅試劑。 參考文獻: Catalyst-controlled doubly enantioconvergent coupling of racemic alkyl nucleophiles and electrophiles. Science, 2020,367, 559–564.