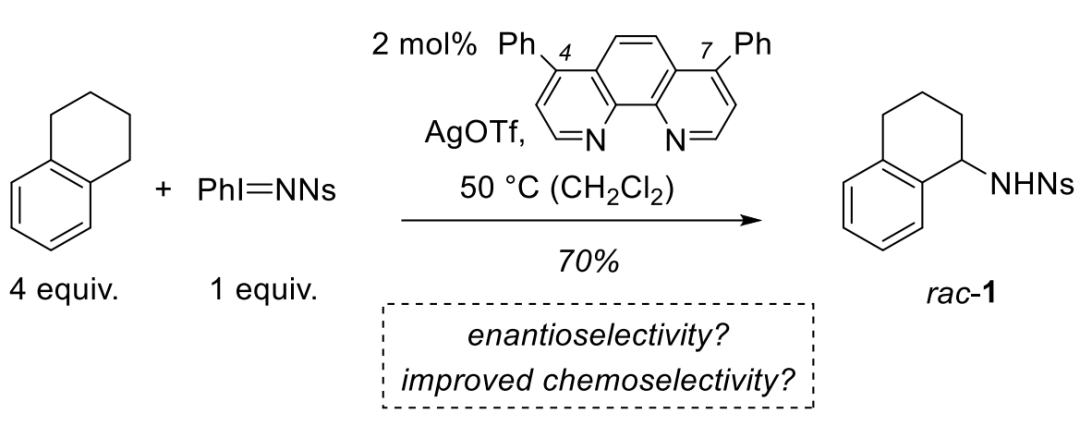
烷基胺基團廣泛存在于藥物活性分子中,因此,化學家發展了許多立體選擇性引入氨基的方法。傳統方式是采用親核取代的方法,但是這需要對底物進行預官能團化。氮賓對C-H鍵的插入反應是另一種直接的方式,但是這種方法的化學選擇性、位點選擇性及立體選擇性均需要控制,是一種充滿挑戰性的方法。在前人的研究中,Davies等課題組設計了許多手性Rh催化劑,實現了立體選擇性的分子間C(sp3)-H胺化反應。2007年,He課題組報道了Ag催化的氮賓插入反應(Scheme 1),實現了C(sp3)-H鍵的胺化。雖然該反應采用PhI=NNs作為定量試劑不夠理想,但是催化劑用量較低且概念新穎,這為發展新型的C-H胺化反應提供了良好啟發。最近幾年里,Ag催化氮賓轉移反應得到了廣泛關注,雖然化學家們實現了分子內的胺化反應,但Ag催化的分子間C-H胺化反應并沒有被報道。最近,德國慕尼黑工業大學的Thorsten Bach課題組設計合成了手性菲咯啉配體,利用氫鍵作用實現了Ag催化的分子間氮賓轉移反應,通過C-H胺化的方式合成了一系列手性胺。相關研究成果發表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.0c02803)。
(來源:J. Am. Chem. Soc.)
(掃描或長按圖中二維碼,識別后直達防疫專區頁面)
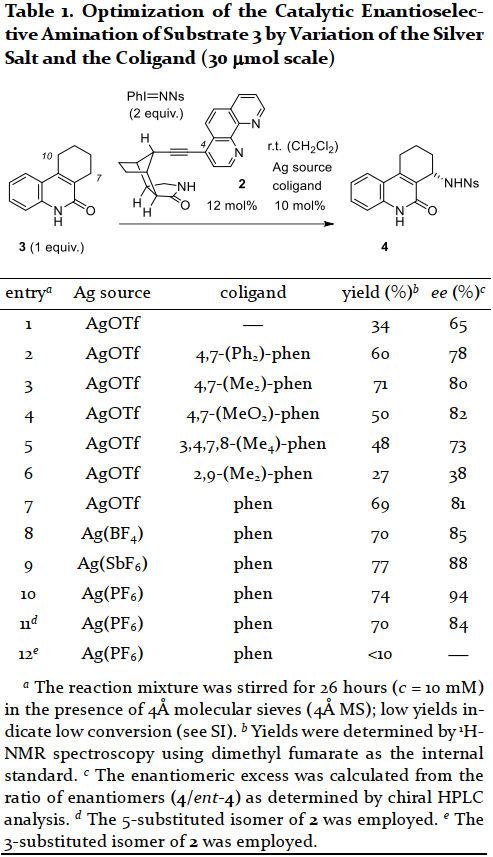
首先,作者采用喹諾酮3為模板底物進行條件優化(Table 1)。通過對配體、銀鹽、協同配體等反應條件的優化,作者確定了最優反應條件為:Ag(PF6)為金屬鹽,手性菲咯啉2為反應配體,phen為協同配體,反應于二氯甲烷中室溫反應26小時,最終可以74%的收率與94%的ee值得到目標產物。值得一提的是,反應具有良好的位點選擇性,只在底物的C7位實現胺化。
(來源:J. Am. Chem. Soc.)
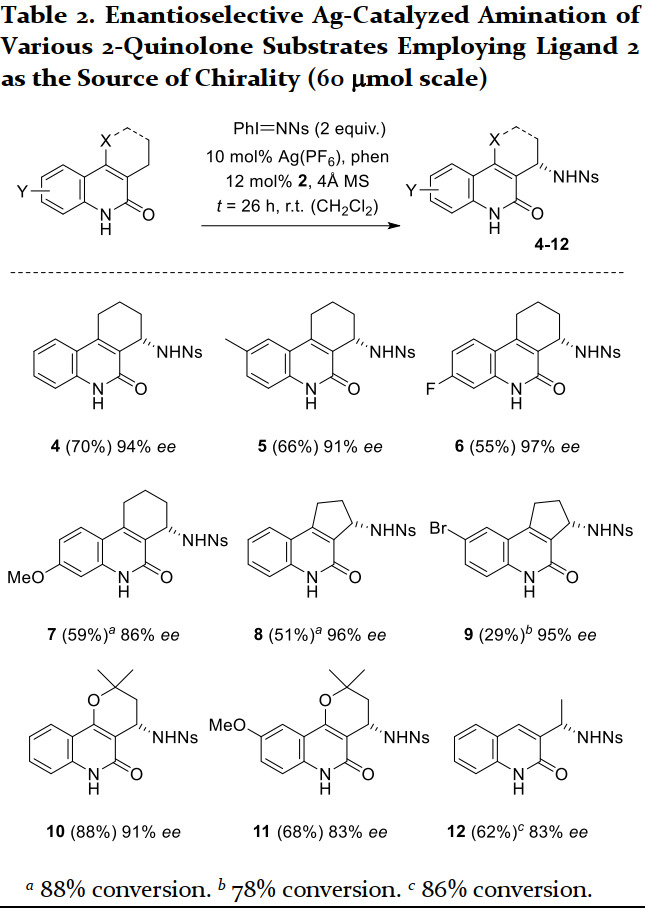
確定最優反應條件后,作者對反應的底物范圍進行了擴展(Table 2)。甲基、氟、甲氧基等官能團均能兼容反應條件,對于非環狀底物,也能以62%的收率與83%的ee值得到目標產物,然而,6位溴取代的底物反應性較差。
(來源:J. Am. Chem. Soc.)
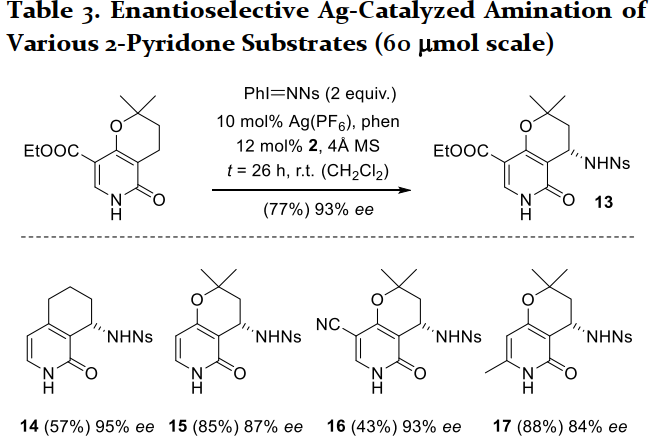
除了喹諾酮類底物,作者隨后又嘗試了吡啶酮類底物(Table 3),均能以良好的收率得到產物。值得注意的是,氫鍵作用不僅可以控制反應的位點及立體選擇性,對于反應的活性保持也起到至關重要的作用。隨后,作者將產物中的Ns基團脫除,說明了反應的實用性。
(來源:J. Am. Chem. Soc.)
為了增加對反應機理的認識,作者隨后進行了初步機理實驗,主要包括:1)驗證了反應并非動力學拆分過程;2)通過KIE實現說明了C-H插入過程并非反應的限速步驟。
小結:Thorsten Bach課題組設計合成了新型配體,并利用配體的氫鍵作用實現了Ag催化亞甲基基團的選擇性胺化反應。該反應位點及立體選擇性良好,為手性胺的合成提供了一類新型的方法。








