摘 要:蒽醌及其衍生物是植物體內十分重要的次級代謝產物,具有光保護、提高植物抗病性等多種功能,同時在醫藥、化工等領域也具有十分重要的應用。如何高效、快速地獲得蒽醌類物質、提高植物體內蒽醌類物質的合成效率,已經成為現代合成生物學的研究熱點。然而蒽醌類物質合成途徑較為復雜,目前普遍認為在植物體內蒽醌類物質是通過莽草酸/鄰琥珀酰苯甲酸途徑和聚酮途徑形成。綜述近年來在植物體內莽草酸/鄰琥珀酰苯甲酸途徑和聚酮途徑合成蒽醌母核結構的研究進展,為研究植物體內蒽醌類代謝物的合成與調控提供一定的理論基礎。
植物次生代謝產物是指不直接參與到植物生長、發育和繁殖過程中的有機化合物。但是次生代謝產物在植物體內分布廣泛,并在植物的整個生命周期中起著十分重要的作用[1]。研究表明很多次生代謝產物在植物生長期內扮演著重要的角色,如充當著植物與周圍環境相互作用的介質[2-4]、充當植物防御系統的重要組成部分[5-6]。近年來,隨著研究的不斷深入,植物次生代謝產物在醫藥領域和膳食營養方面得到了廣泛應用,所以對植物次生代謝產物的研究已經成為熱點。
蒽醌及其衍生物是植物體內十分重要的次生代謝產物,在植物中具有多種功能,如光保護[7]、提高植物抗病性[8]等功能。研究發現蒽醌類物質的合成代謝在細菌、真菌、地衣和高等植物中均存在[9-10]。高等植物中的蒽醌類物質主要分布在廖科(Polygonaceae)、豆科(Leguminosae)、鼠李科(Rhamnaceae)、茜草科(Rubiaceae)、黃脂木科(Xanthorrhoeaceae)植物中[11],而且自然界植物體內的蒽醌不僅以簡單的游離形態存在,還有相當一部分是以其衍生物的形式存在。很多蒽醌類代謝產物具有十分重要的藥理活性,例如大黃酸、大黃素、大黃酚、大黃素甲醚和蘆薈大黃素5種蒽醌類物質是大黃主要的藥效成分,具有抗菌、消炎[12]、抗癌[13]等功效。由于蒽醌類物質在醫藥和生物領域的重要作用,如何高效、快速地獲得蒽醌類物質,提高植物蒽醌類物質的合成效率,已成為了生命科學研究的熱點方向。所以研究植物和微生物體內的蒽醌代謝機制,對蒽醌類物質的高效生產具有十分重要的意義。
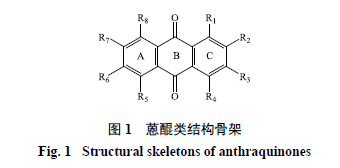
研究發現蒽醌類物質的合成十分復雜,合成前體涉及多個代謝途徑的產物。目前對蒽醌類成分的生物合成途徑尚未完全闡明,但是普遍認為植物體中蒽醌類物質(圖1)生物合成主要來源于2條代謝途徑:莽草酸/鄰琥珀酰苯甲酸途徑(shikimate/ o-succinylbenzoicacid route)和聚酮途徑(polyketidepathway)。莽草酸/鄰琥珀酰苯甲酸途徑主要存在于茜草科植物體內,因此將該途徑下產生的蒽醌也稱之為茜草型蒽醌。經過該途徑生物合成的蒽醌在C環中帶有1個羥基化位點。聚酮途徑則主要存在于一些真菌和高等植物的科屬中,如豆科、廖科、鼠李科植物中。該途徑可以為生物提供包括蒽醌和奈醌在內的醌類物質,以及包括黃酮類在內的各種苯丙素類物質。通過聚酮途徑生成的蒽醌,其A環與C環往往會表現出一定的羥基化特性,例如在鼠李科和廖科植物中發現的大黃素與大黃酚就具有這種特性[14]。目前聚酮途徑所涉及的酶系統在微生物體內已經得到了廣泛的驗證,但在高等植物體內研究較少[15]。本文對近年來蒽醌類物質的代謝途徑研究進行了整理,將蒽醌類化合物生物合成所涉及的途徑:莽草酸途徑、三羧酸(TCA)循環、甲羥戊酸(mevalonate,MVA)、甲基赤蘚醇磷酸(methyl erythritol phosphate,MEP)途徑、聚酮途徑進行了整合梳理,為蒽醌類物質的生物合成代謝研究提供一定的理論基礎。
1 莽草酸/鄰琥珀酰苯甲酸途徑
莽草酸/鄰琥珀酰苯甲酸途徑合成蒽醌母核的前體來自于多種代謝途徑。該合成途徑主要涉及莽草酸途徑、TCA循環、MVA途徑和MEP途徑。
通過該途徑合成蒽醌母核的主要步驟:以莽草酸途徑形成的異分支酸(isochorismic acid,IC)、來自于TCA循環的α-酮戊二酸(α-ketoglutarate,AKG)和硫胺二磷酸(thiaminediphosphate,TPP)為底物,在鄰琥珀酰苯甲酸(o-succinyl benzoic acid,OSB)合成酶作用下與TPP生成OSB,釋放出CO2和磷酸烯醇丙酮酸(phosphoenolpyruvate,PEP)[16-17];然后OSB輔酶A連接酶(OSB-CoA ligase)將OSB的琥珀酰側鏈激活,形成OSB-CoA(CoA ester of OBS);OSB-CoA隨后在DHNA-CoA合酶與DHNA-CoA硫酯酶(DHNA-CoA thioesterase)作用下環化生成1,4-二羥基-2-苯甲酸(1,4-dihydroxy- 2-naphthoic acid,DHNA),作為蒽醌母核的A、B環[18-19];DHNA與二甲基烯丙基焦磷酸(3,3-dimethylallyl diphosphate,DMAPP)結合環化,作為蒽醌母核的C環[20],最終形成蒽醌的母核結構(圖2)。
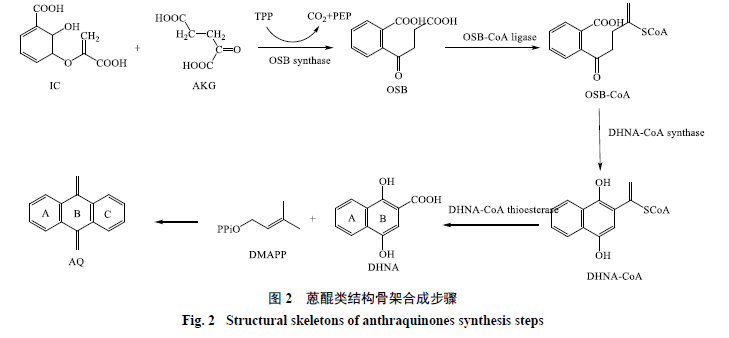
莽草酸/鄰琥珀酰苯甲酸途徑形成蒽醌母核的過程中IC、AKG、DMAPP為反應的進行提供物質基礎,所以這幾種物質的供應對代謝途徑的持續進行具有十分重要的作用[21-23]。
1.1 莽草酸途徑合成IC
莽草酸途徑在細菌、真菌、植物體內均有分布,為芳香類物質的合成提供了前體物質,目前在動物體內尚未發現[24-25]。研究發現微生物可以通過莽草酸途徑產生芳香族氨基酸作為蛋白質生物合成的物質基礎,如L-苯丙氨酸(L-Phe)、L-酪氨酸(L-Tyr)和L-色氨酸(L-Trp)等[26];在植物體內,這些代謝產物不僅參與蛋白質的合成,還是多種次生代謝物合成的前體物質[27],可以根據植物生長的需要進一步合成多種代謝產物,這些代謝產物在植物生長和抗逆作用中具有十分重要的作用[28-29]。其中IC就是通過該途徑,經由多個連續的酶促反應生成的[30]。
莽草酸途徑生成IC的主要反應步驟來自于糖酵解途徑的PEP和來自磷酸戊糖途徑的D-赤蘚糖- 4-磷酸(D-erythrose-4-phosphate,E4P)在DAHP合酶(DAHP synthase)的催化下羥醛縮合生成3-脫氫-D-阿拉伯糖庚酮糖-7-磷酸(3-deoxy-D-arabino- hetulosonate-7-phosphate,DAHP);DAHP在3-脫氫奎尼酸合成酶(3-dehydroquinate synthase,DHQS)作用下去磷酸、環化生成3-脫氫奎尼酸(3- dehydroquinate,DHQ),此步驟為TCA循環的限速步驟。DHQ可以進一步生成奎尼酸(quinic acid),或者在3-脫氫喹啉酸脫水酶(DHQ dehydratase)的作用下脫水,并生成3-脫氫莽草酸(3- dehydroshikimic acid,DHS);生成的DHS可以作為莽草酸途徑的分支點從而進一步生成原兒茶素(protocatechuic acid)和沒食子酸(gallic acid);或者DHS在莽草酸脫氫酶(shikimatedehydrogenase,SDH)作用下與還原型煙酰胺腺嘌呤二核苷酸磷酸(NADPH)發生還原反應,生成莽草酸和煙酰胺腺嘌呤二核苷酸磷酸(NADP+);莽草酸在莽草酸激酶(shikimate kinase enzyme,SK)作用下消耗三磷酸腺苷(adenosine triphosphate,ATP)生成莽草酸3-磷酸(shikimic acid 3-phosphate,S3P);S3P與PEP在5-烯醇丙酮莽草酸3-磷酸合成酶(5- enolpyruvylshikimate3-phosphate synthase,EPSPS)催化下縮合,產生5-烯醇丙酮莽草酸3-磷酸(5-enolpyruvylshikimate3-phosphate,EPSP);EPSP在分支酸合酶(chorismate synthase,CS)作用下,去磷酸形成分支酸(chorismicacid,CHA);CHA在IC合成酶(isochorismatesynthase,ICS)作用下生成IC[31-32],為蒽醌的生物合成提供基礎物質,見圖3。
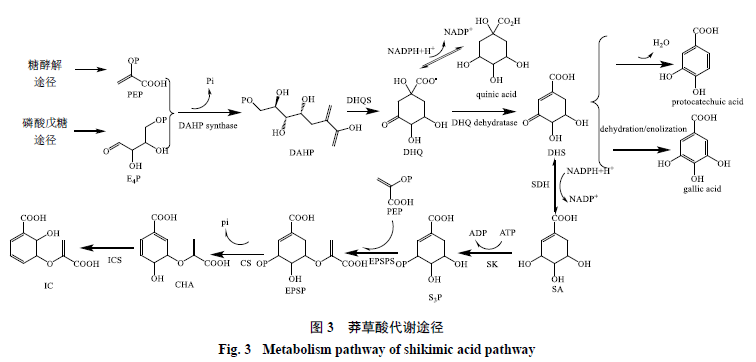
植物細胞在進行正常代謝時,需要在初級代謝與次級代謝之間進行合理分配。由于次級代謝反應往往是從初級代謝反應中獲取前體物質,所以當植物初級代謝反應與次級代謝反應同時進行時,就需要合理調控二者之間的關系,以達到生產所需要的目的。初級代謝與次級代謝之間的分支點往往是控前體物質分配的關鍵位點。IC是莽草酸途徑的產物,不僅是多種次級代謝途徑的起始物質,也是蒽醌代謝合成中的重要底物[33-34]。ICS是催化CHA生成IC進入蒽醌形成途徑的關鍵酶,在蒽醌合成調控中發揮重要作用。文獻報道在巴戟天細胞培養液中蒽醌的產生總是伴隨著ICS活性的增加而增加,即使在分支酸濃度較低,不足以維持正常生長的極端條件下,蒽醌積累速率與ICS活性之間仍然存在相關性[21]。
1.2 TCA途徑生成AKG
TCA循環在動植物、微生物細胞中普遍存在。TCA循環以乙酰輔酶A(acetyl-CoA)與草酰乙酸(oxaloacetate acid,OAA)縮合生成檸檬酸(citrate acid,CA)為起始,途徑多個酶促反應,最后又生成OAA。在連續的酶促反應中會生成多種中間產物,蒽醌生物合成的原料物質AKG則來自于這一代謝途徑。
TCA循環以OAA為起始經過多步酶促反應生成AKG,主要反應步驟如下:乙酰輔酶A與四碳的OAA發生縮合反應,生成CA。此步反應由CA合酶(citrate synthase,CS)催化,該酶具有高度的底物特異性,僅催化乙酰輔酶A與OAA縮合生成CA。此反應不可逆,ATP是CS的變構抑制劑。CA在烏頭酸酶(aconitase,CAN)的催化作用下經過2步連續反應,生成異檸檬酸(isocitrateacid,ICA),催化反應的CAN主要分布于胞漿和線粒體之中,此步反應是可逆的,高濃度的CA可以促使反應向生成ICA的方向移動。ICA在ICA脫氫酶(isocitrate dehydrogenase,IDH)作用下,經中間體草酰琥珀酸(oxalosuccinate acid)氧化脫羧生成AKG。此步反應不可逆,是整個TCA循環中的限速步驟。ADP是IDH的激活劑,而ATP、NADH是該酶的抑制劑,而且IDH需要在Mg2+或Mn2+離子的輔助下才可以發揮活性。生成的AKG之后會作為蒽醌母核結構的合成底物參與反應;或者在AKG脫氫酶復合體(α-ketoglutarate dehydrogenasecomplex,α-KGDH)的催化作用下,與輔酶A化合,生成琥珀酰輔酶A(succinyl-CoA),再經過之后的多步反應,重新生成OAA(圖4)。
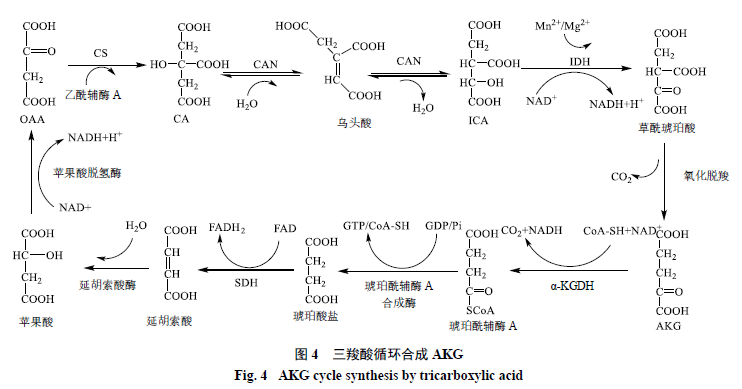
AKG是莽草酸/鄰琥珀酰苯甲酸途徑合成蒽醌的重要物質基礎,提高AKG的含量可以促進蒽醌類物質的生物合成。Zenk等[22]通過對巴戟天細胞培養發現,提高培養液中AKG的濃度,可以明顯促進蒽醌類物質生物合成,證實了AKG在蒽醌生物合成中的重要作用。TCA途徑中實現AKG的積累需要滿足2個條件:一是提高乙酰輔酶A的含量,使其進入TCA循環,促進AKG的積累;二是阻止α-KGDH催化AKG進入之后的代謝途徑[35-36],從而為蒽醌合成提供充足的前體物質,促進蒽醌代謝合成。α-KGDH抑制劑主要有過氧化氫(H2O2)、羥基硫胺(oxythiamine)和次氯酸鈉(NaClO)等。過氧化氫會在細胞內形成氧脅迫,從而抑制線粒體中α-KGDH的活性[37]。次氯酸鈉會與細胞內的氨基反應生成氯胺而降低α-KGDH活性[38]。羥基硫胺則是作為硫胺素的結構類似物,與硫胺素形成競爭性
抑制從而降低α-KGDH活性[39]。
1.3 異戊烯焦磷酸(IPP)和DMAPP的生物合成
IPP和DMAPP是合成蒽醌類化合物的重要前體物質。目前廣泛認為生物體內IPP與DMAPP合成主要有2種途徑,即MVA途徑和MEP途徑[40-41],因此對這2條代謝途徑分別進行論述。
1.3.1 MVA途徑 MVA途徑長期以來都被認為是萜類化合物生物合成的唯一途徑[42],于1958年首先在動物和酵母中發現,該途徑主要在細胞質中進行。在MVA途徑中,首先由2分子乙酰輔酶A(丙酮酸脫羧的產物)在乙酰乙酰輔酶A硫解酶(acetoacetyl-CoA thiolase)催化下發生縮合生成乙酰乙酰輔酶A(acetoacetyl-CoA)[43];乙酰乙酰輔酶A與乙酰輔酶A在3-羥基-3-甲基戊二酸單酰輔酶A合成酶(HMG-CoA synthase)作用下進一步縮合生成3-羥基-3-甲基戊二酸單酰輔酶A(HMG-CoA)[44];HMG-CoA在HMG-CoA還原酶(HMG-CoA reductase)作用下被NADPH還原為MVA[45];MVA在甲羥戊酸激酶(mevalonic acid kinase,MVK)催化下消耗1分子ATP生成5-磷酸甲羥戊酸(mevalonate-5-phosphate,MVA-P),再由磷酸甲羥戊酸激酶(phosphomevalonate kinase,PMK)催化消耗1分子ATP生成5-焦磷酸甲羥戊酸(mevalonate-5-diphosphate,MVADP)[46-48];MVADP由5-焦磷酸甲羥戊酸脫氫酶(mevalonatedisphosphate decarboxylase,MDD)催化生成為異戊二烯焦磷酸(isopentenyldiphosphate,IPP);IPP并不能直接和NHNA環化形成蒽醌母核結構,需在異戊二烯焦磷酸異構酶(isopentenyl diphosphate isomerase,IDI)催化下生成DMAPP,之后再與DHNA發生環化反應[49],見圖5。
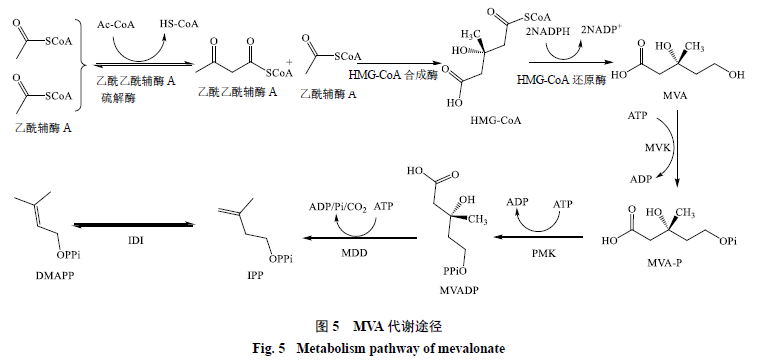
研究發現MVK、HMG-CoA還原酶是調控MVA的關鍵酶[50-51],Anthony等[52]發現升高MVK的表達量可以提高異戊二烯類物質的含量。Narita等[51]發現抑制HMG-CoA還原酶活性后,會明顯地抑制番茄果實的正常生長,但是當加入MVA后,植株又恢復正常生長,進一步說明HMG-CoA在MVA 途徑中的重要作用。
1.3.2 MEP途徑 IPP與DMAPP除了通過MVA途徑合成以外,還可以通過MEP途徑合成。自1993年發現MEP途徑以來,對該途徑的研究已經取得了顯著的進展。MEP途徑由多個連續的酶促反應以D-甘油醛-3-磷酸和丙酮酸為底物,催化合成IPP和DMAPP[53]。
MEP途徑首先由D-甘油醛-3-磷酸和丙酮酸在脫氧木酮糖磷酸合成酶(1-deoxy-D-xylulose-5- phosphate synthase,DXS)作用下發生縮合反應,產生1-脫氧-D-木酮糖-5-磷酸(1-deoxy-D-xylulose 5-phosphate,DXP)[54];DXP經DXP還原異構酶(DXP reducto-isomerase,DXR)還原異構化為MEP,期間消耗NADPH產生NADP+[55];MEP和三磷酸胞苷(cytidine 5′-triphosphate,CTP)由CDP-ME合成酶(CDP-ME synthetase)催化,產生甲基赤蘚糖醇胞苷二磷酸(methylerythritol cytidyl diphosphate,CDP-ME);CDP-ME在CDP-ME激酶(CDP-ME kinase)催化下形成4-二磷酸胞苷-2-C-甲基-D-赤蘚糖醇-2-磷酸酯(4-diphosphocytidyl-2-C-methyl-D- erythritol-2-phosphate,CDP-MEP);CDP-MEP在2-C-甲基-D-赤蘚糖醇-2,4-環二磷酸合成酶(MEcPP synthase)催化下環化生成2-C-甲基-D-赤蘚糖醇-2,4-環二磷酸(2-C-methyl-D-erythritol-2,4-cyclodiphosphate,MEcPP)[56-57];MEcPP在MEcPP還原酶作用下開環、脫水生成4-羥基-3-甲基-丁烯基二磷酸(4-hydroxy- 3-methyl-butenyl-1-diphosphate,HMBPP)[58];MEP途徑的最后一步由HMBPP還原酶(HMBPP reductase)催化,并將HMBPP轉化為IPP和DMAPP,此步驟中即生成IPP也生成DMAPP,見圖6。所以與MVA途徑不同,并不需要ID來催化DMAPP[59-60]。
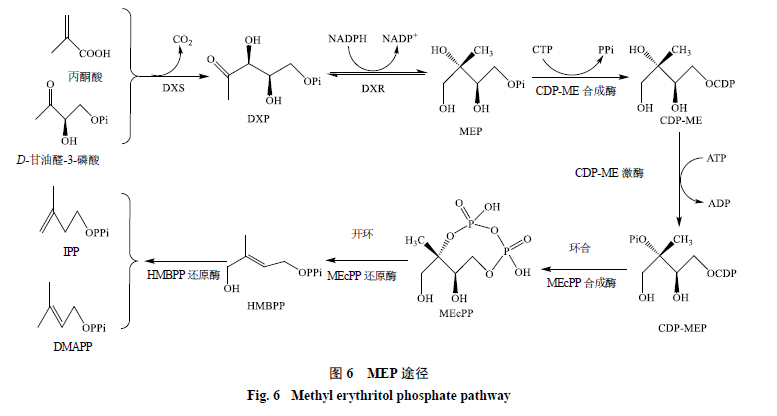
有學者認為,可以通過調控MEP途徑來影響蒽醌的生物合成[23]。DXS催化丙酮酸和甘油醛發生縮合反應生成DXP,此步驟是MEP途徑的起始步驟,具有十分重要的作用。Estevez等[61]在擬南芥植株中控制DXS基因過表達,發現相應的轉基因植物中多種類異戊二烯終產物(包括葉綠素、類胡蘿卜素、生育酚和ABA)的含量均升高,說明DXS是MEP途徑中關鍵的限速酶,具有調控MEP途徑的重要作用。Quevedo等[62]通過培育過表達DXS基因的Morinda citrifolia細胞系,發現與對照細胞系相比,過表達DXS基因的細胞系蒽醌產量提高了約24%,說明DXS對蒽醌的生物合成具有十分顯著的影響。有實驗表明在MEP途徑中除了DXS外,DXR和HMBPP還原酶在IPP和DMAPP合成中也具有限速作用。但是對這2種酶的調控研究還較少,需要通過進一步的研究來確定這2種酶對整個MEP途徑的影響能力和控制條件[63]。所以目前DXS仍然是調控MEP途徑最有效的位點。
2 聚酮途徑(polyketide pathway)
聚酮途徑在植物體內扮演著十分重要的角色,同時也是植物合成蒽醌類物質的重要途徑。但是聚酮途徑合成蒽醌類物質的過程十分復雜,目前研究還未完全闡明反應的全部過程。目前得到廣泛認可的聚通途徑合成蒽醌類物質的過程見圖7。首先乙酰輔酶A或丙二酰輔酶A為底物在聚酮合成酶III(PKSIII)作用下進行一系列的縮合反應并不斷延長C鏈,最后形成聚酮鏈。研究人員推測生成的聚酮長鏈可能會經過S或F折疊和多重環化脫羧合生成蒽酮類物質的結構骨架。生成的蒽酮類物質結構骨架再進一步氧化最終形成蒽醌類物質的結構骨架結構[64-68]。
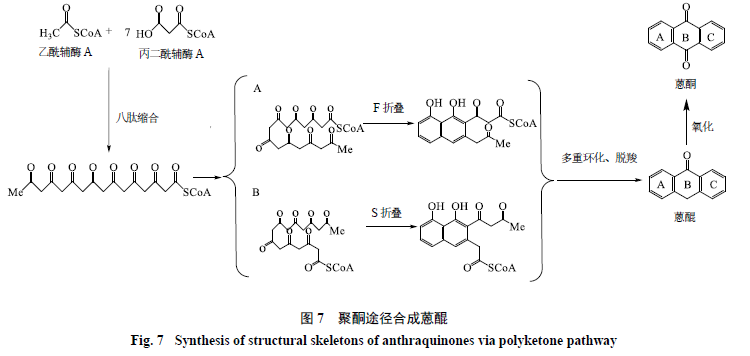
2.1 PKS
2.1.1 PKS的分類 聚酮途徑是由PKS參與反應。PKS分為3大類[69]:PKS I、PKS II和PKS III。PKS I是1類由多個結構域組成的巨形酶,多存在于真菌中,在細菌中也有廣泛分布[70-71],主要負責大環內酯與相關聚烯類物質的生物合成[72],所有的酮基還原中間體均可以在PKS I中找到相其關催化基團。PKSII是由多個單功能酶組成的多酶復合體。PKS II會與底物通過多次反應形成聚酮結構,然后經過酶促反應使生成的聚酮結構環化,從而形成多環芳族化合物。目前,在多種細菌屬中均發現了PKS II,以及其相應的代謝產物[73]。PKS III也稱為查耳酮合成酶家族(CHSs),不僅在細菌、真菌中廣泛分布,而且在植物體內也大量存在。PKS III在生物體內主要參與具有生物活性的聚酮類次級代謝產物的合成,例如黃酮類物質、二苯乙烯類物質的生物合成[74-76]。與PKS I、PKS II利用酰基載體蛋白,在多個活性位點催化反應不同,PKS III僅在單個活性位點進行一系列脫羧,縮合和環化,最終生成目標產物[77-78]。近年來隨著研究的深入,多種植物型PKS III被陸續發現:如CHS[79]、二苯乙烯合酶[80](stilbene synthase,STS)、吖啶酮合酶[81](acridone synthase,ACS)、2-吡喃酮合酶[82](2-pyrone synthase,2PS)、聚八酮合酶(ctaketide synthase,OKS)[83]等。
2.1.2 PKS III酶的活性表達 PKS III在酶促反應中的活性表達可以分為2個步驟:首先是在PKSIII作用下催化底物經過多次縮合,生成線性聚酮化合物中間體;之后產生的聚酮化合物中間體通過分子內環化生成最終代謝產物[84]。
PKS III活性表達的第1步反應中,PKS III的起始底物通常是酰基輔酶A,既可以是鏈形酰基輔酶A(如丙二酰基輔酶A和乙酰乙酰基輔酶A),也可以是環型酰基輔酶A(如香豆酰-輔酶A、苯甲酰-輔酶A及其衍生物)。目前已知的PKS III酶均可以使用丙二酰輔酶A作為縮合底物進行反應,除此之外部分PKS III酶還可以將其他物質作為縮合底物使用。如甲基丙二酰基輔酶A、乙基丙二酰基輔酶A、乙酰乙酰基-輔酶A等[85]。PKS III活性表達的第2步反應中,可以將PKSIII催化聚酮化合物中間體環化的過程分為4種類型,即克萊森環化(claisencyclization)、醛醇環化(aldolcyclization)、內酯化(lactonization)、多重環化(multiple cyclization)。
其中克萊森環化是指在2個脂或者1個脂1個羰基,在堿性條件下縮合成環的反應,如在苯異戊二酮合酶(phlorisovalerophenonesynthase,VPSs)催化下異戊基輔酶A和異丁基輔酶A環化生成phlorisovalerophenone的反應[86];醛醇環化是指具有α氫原子的醛基或酮基在一定條件下與羰基發生環化的反應,如olivetol合成酶(OLS)以己酰基-輔酶A為起始底物產生四酮中間體,并進一步將其轉化為olivetol的反應過程[87]。內酯化是指同一化合物的羥基和羧基發生分子內縮合環化得到最終產物的反應,如CPKS5催化下丁基-輔酶A與2個丙酰-輔酶A單元發生縮合反應,并進一步生成吡咯酮類產物[88]。多重環化則是指反應底物通過多種成環方式,最終生成多環化合物的反應,如octaketide合酶(OKSs)催化7分子丙二酰輔酶A與乙酰輔酶A縮合,形成聚酮鏈,然后經過多重環化最終合成目標產物的過程就屬于多重環化[89]。
2.2 PKS III酶的生理功能
近年來隨著研究的深入發現PKS III酶在生物體內分布廣泛,如在掌葉大黃Rheum palmatum L.[90]、虎杖Polygonum cuspidatum Sieb. et Zucc.[91]、何首烏Fallopia multiflora (Thunb.) Harald.[92]、蕎麥Fagopyrum esculentum Moench.[93]中均發現了CHSs,CHSs還可以和查耳酮異構酶(chalcone isomerase)、黃酮醇合酶(flavonol synthase)、異黃酮合成酶(isoflavone synthase)、聚酮還原酶(polyketide reductase)等多種酶共同參與植物體內多種化學物質的生物合成[94]。不僅如此,PKS III酶家族催化生成的聚酮化合物及其衍生物在植物體內也具有十分重要的作用,比如防止紫外線造成損傷、抵抗病原生物侵染食等功能[95]。
部分生物中CHSs基因的表達通過光受體介導機制調控,如Xanthoria parietina L.是一種分布廣泛的地衣生物,有學者研究發現外界紫外線照射的強度變化會顯著影響CHSs基因的表達,從而影響其蒽醌類物質的合成[96]。Mariz-Ponte等[97]研究發現適當的紫外照射會促使番茄植株CHS和FLS等基因表達的上調,進而促進黃酮類、苯丙素類等芳香族化合物的積累。Feinbaum等[98]發現南芥中CHSs基因的表達受紫外照射的調控,適當增強紫外照射會顯著增加CHSs的活性。
植物抗毒素作為植物抵抗微生物侵害的重要物質,在植物遭受病原體侵襲后,其含量在植物體內會顯著增加。例大豆Glycine max L. 在被核盤菌感染后,異黃酮、染料木黃酮和黃豆黃素含量會顯著增加;高粱Sorghumbicolor L. 接種炭疽桿菌后其木犀草素的含量會顯著上升;這些黃酮類、異黃酮類植物抗毒素的合成與PKS III酶家族密切相關[99-100]。有研究發現高濃度的蒽醌類物質含量可以有效降低致病菌的存活率。Martínez-Romero等[7]對不同處理的蘆薈Aloe vera L. 葉片接種真菌,結果發現紫外光照射后的蘆薈葉片對真菌侵染具有更強的抵抗能力,這是由于長時間的紫外光照射使蘆薈葉片中蘆薈素含量升高所導致;還有研究發現大黃根莖富含蒽醌、酚酸類物質的提取液可以有效提高植物抗霜霉病菌侵染的能力[8]。
3 結語與展望
蒽醌類物質在生物體內的合成過程十分復雜,整個過程涉及多條代謝途徑的多種代謝產物。本文綜述了蒽醌類物質合成的2條主要代謝途徑,即莽草酸/鄰琥珀酰苯甲酸途徑和聚酮途徑。莽草酸/鄰琥珀酰苯甲酸途徑主要存在于茜草科植物中,該途徑合成步驟涉及莽草酸途徑、TCA
來源:中草藥雜志社








