分享一篇發表在NCB上的文章,題目為“A small-molecule VHL molecular glue degrader for cysteine dioxygenase 1”,通訊作者是來自諾華的Gregory A. Michaud博士。在本文中,作者發展了一種用于結合半胱氨酸雙加氧酶1(CDO1)和VHL的分子膠,用于招募E3泛素連接酶,實現底物的降解。

分子膠降解劑(molecular glues)能夠誘導細胞內的E3泛素連接酶與特定的蛋白質底物形成新的相互作用,從而促進底物的降解。與PROTAC相比,分子膠降解劑由于具有更好的成藥性而受到廣泛的關注。除CRBN外,VHL也是一種E3泛素連接酶復合體的底物識別組分,其天然底物是缺氧誘導因子HIF-1α。在本文中,作者希望通過蛋白陣列篩選策略探究能夠通過分子膠被VHL降解的蛋白。
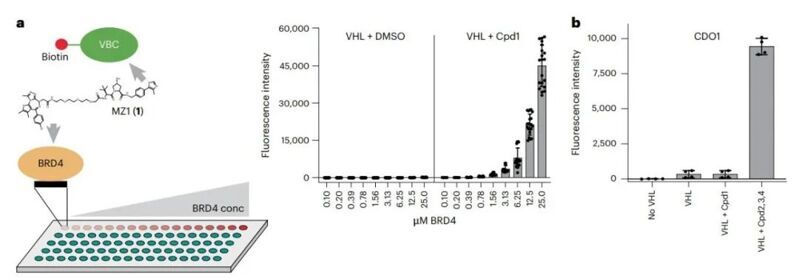
在蛋白陣列篩選實驗中,作者采用了生物素化pVHL、Elongin B和Elongin C(bio-VBC)復合物作為讀出,篩選能夠通過分子膠結合VHL的底物蛋白。首先,他們采用了已知具有結合作用的BRD4蛋白以及對應的PROTAC分子(cpd1)作為驗證,發現隨著BRD4濃度的升高熒光強度增強,表明了方法的可行性。隨后,作者采用了由>9000個人源蛋白組成的微陣列(ProtoArray),分別加入三種此前發表的VHL結合分子(cpd234),并采用cpd1作為負對照。其中,他們發現半胱氨酸雙加氧酶1(CDO1)能夠產生較強的熒光信號,表明其中一種或多種分子能夠促進VHL-CDO1復合物的形成。隨后作者又通過SPR實驗證明了其中cpd4能夠促進CDO1與VHL結合,KD約為0.82 μM。
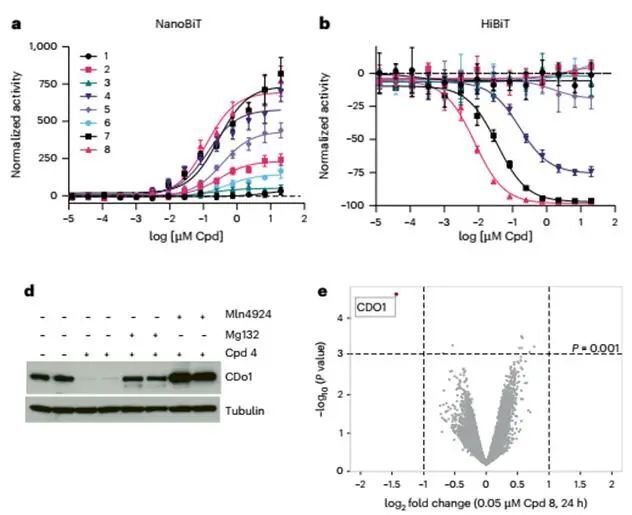
隨后,作者檢測了在細胞中cpd4是否可以將CDO1募集到細胞中的VHL,結果表明在細胞中加入cpd4確實能夠形成三元復合物,并能夠在17 h內促進CDO1降解。而在加入VHL抑制劑和蛋白酶體抑制劑是則可以阻斷cpd4誘導的降解,這表明了cpd4的確是CDO1的VHL依賴性分子膠降解劑。此外,作者也進一步優化了化合物結構得到了特異性更強的cpd8。
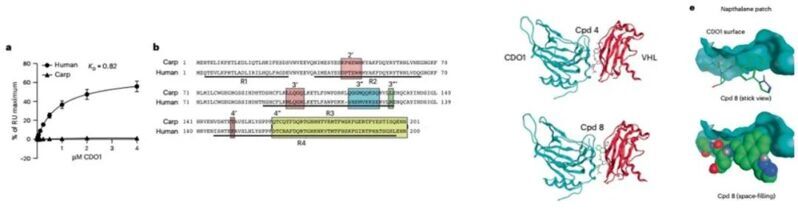
接下來,為了研究CDO1-cpd4-VHL的相互作用界面,作者純化了11個物種的 CDO1蛋白,而后通過SPR測試復合物的形成。他們發現只有鯉魚(Cyprinus)中的CDO1不能與VHL形成三元復合物。通過比對人類和鯉魚的CDO1序列,作者發現二者在R1(Q3-E27)、R2(A35-Q65)、R3(N90-R126)和R4(I145-L197)這四個區域存在差異,表明這可能就是與復合物形成有關的界面。最后,作者也解析了三元復合物的晶體結構,進一步證明了二者的相互作用界面。
總而言之,作者采用蛋白陣列篩選策略探索了蛋白質組中能通過分子膠與VHL互作的蛋白,其中發現CDO1能夠作為VHL的新底物實現靶向降解。
本文作者:WYQ
責任編輯:MB
DOI:10.1038/s41589-025-01936-x
原文鏈接:https://doi.org/10.1038/s41589-025-01936-x








