自1977年法國化學家Kagan等[1]將二碘化釤引入到有機化學中以來, 釤試劑的應用才逐漸受到人們的重視. 近些年來, 二碘化釤在有機合成中應用的研究取得了飛速的發展, 國內外陸續報道了很多關于二碘化釤在有機合成中應用的綜述性文章[2].
由于SmI2具有較高的還原電位[E0(aq)(Sm3+/Sm2+)=-1.55 V], 且能溶于四氫呋喃(THF)等有機溶劑, SmI2已迅速成為廣泛使用的單電子轉移還原偶聯劑, 在有機合成中得到了廣泛的應用.
SmI2 作為一種優良的單電子轉移試劑促進的反應類型很多, 比如還原反應、吶醇偶聯反應、Reformatsky反應、自由基加成反應等. 同時, 它還可以作為預催化劑催化Aza-Michael反應、Friedel-Crafts反應等.

1.1 羰基的還原
SmI2 在有機化學中最早的應用便是醛酮的還原反應[1], 對于絕大多數SmI2參與的反應中都發生了還原.
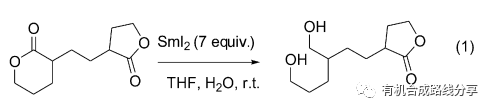
在室溫條件下, 酯也可以被還原. Procter 等[3]發現當SmI2的用量增加到7倍量時, 將六元環內酯和五元環、七元環內酯甚至鏈狀的酯放在同一體系中反應, 結果SmI2只選擇性地將六元環內酯還原為相應的1,5-二醇(Eq. 1), 其他酯類基本上沒有發生還原反應.
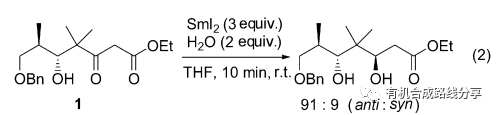
當羰基化合物的β位同時含有羥基和大的位阻基團時, 可以誘導羰基的還原, 化合物1在SmI2作用下產物以anti式為主(Eq. 2)[4].
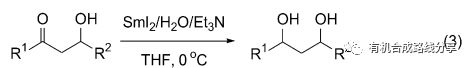
Flowers等[7]也同樣報道了β-羥基酮的還原, 他們采用的是SmI2/H2O/Et3N作為還原體系, 在0 ℃下5 min內便可完全反應, 并且以順式產物為主(Eq. 3). 當R1為苯基, R2為乙基時syn∶anti的比例大于9∶1.
1.2 烯烴的還原
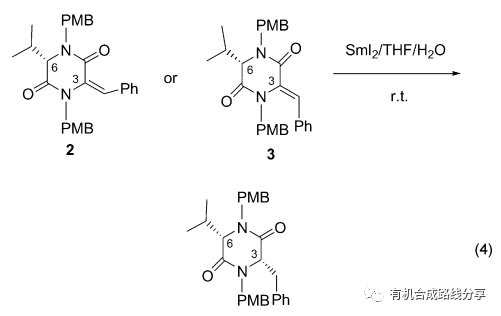
烯烴的雙鍵碳上連有羰基、酰胺等吸電子基團時, 在SmI2作用下可以將雙鍵還原. 2005年Davies等[8]報道了α,β-不飽和環內酰胺的還原反應, 該反應以水為質子源, 當反應底物2和3的6位有不對稱中心時, 在空間位阻效應的影響下還原產物de 值(非對映體過量)可以達到96%, 產率也很高達到93% (Eq. 4).
1.3 其他還原反應
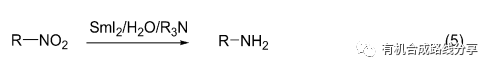
前面提到SmI2/Amine/H2O體系有強的還原能力, 可以在低溫條件下短時間內羰基還原. 基于這一還原體系的強還原性, Hilmersson 等[9]將其用于硝基烷的還原, 產物為伯胺(Eq. 5), 而在α,β-不飽和硝基烷的還原中總是伴隨碳-碳雙鍵的還原.
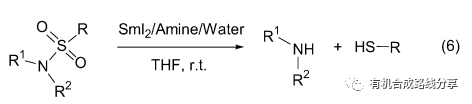
另外SmI2/Amine/H2O體系還可用于磺酰胺的脫保護反應得到相應的胺(Eq. 6)[10], 當R=alkyl時基本上沒有反應, 而當R=aryl 時反應進行很順利, 產率也很高都在90%以上. 同時該還原體系也可以用于磺酸酯的脫保護得到相應的醇.
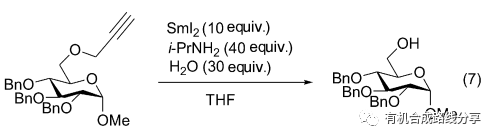
最近Manabe等[11]發現SmI2/Amine/H2O體系也可以用于炔丙基醚的還原脫保護, 脫去炔丙基得到相應的醇(Eq. 7).

2.1 吶醇偶聯反應
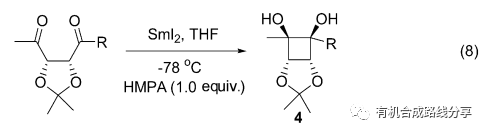
在SmI2作用下醛酮得到一個電子變成羰基自由基, 在氧原子和Sm3+的配位作用下, 可以發生吶醇偶聯反應. 借助SmI2可以構建鏈狀、環狀具有吶醇結構單元的化合物. 在此基礎上, Williams 等[12]以1,4-二丁酮合成了1,2-環丁二醇4(Eq. 8).
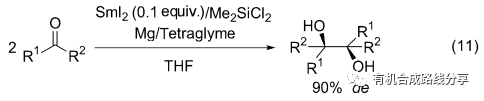
對于大部分SmI2引發的醛酮的偶聯反應都至少需要2 equiv.的SmI2參與反應, 而Greeves等[15]發現以鎂作為Sm3+的還原劑在反應中加入Me2SiCl2可以SmI2的用量降低到10 mol%, 并且部分產物的de值可以到90% (Eq. 11).
2.2 亞胺類化合物的還原偶聯
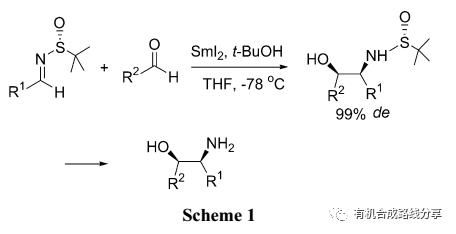
β-胺基醇是藥物和天然產物的重要結構片段. N-叔丁基亞砜基亞胺是合成手性胺很好的手性前體, 林國強等[17]在這方面作了大量的工作. 2005年林國強等[18]報道了SmI2引發的亞胺和醛的不對稱偶聯反應, 在N原子上叔丁基亞砜基的誘導下偶聯產物的de值(非對映體過量)最高可達99%, 然后經酸化處理便得到β-胺基醇類化合物(Scheme 1). 由于苯甲醛具有很高的反應活性, 很容易發生自身偶聯反應, 在這些反應中只有脂肪醛才能給出很好的結果.
2.3 其他還原偶聯反應
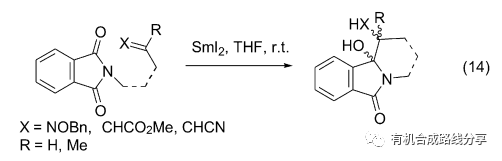
2007年Chiara等[22]報道了鄰苯二甲酰亞胺作為一種高效的單電子轉移受體引發的一系列分子內或分子間還原偶聯反應(Eq. 14), 而反應的產物α-羥基內酰胺是合成異吲哚啉酮類生物堿的重要中間體.

在有機合成中消除反應是得到烯烴的重要方法, SmI2引發的β-消除反應具有條件溫和, 產率高而且立體選擇性好的優點, 這也吸引了更多的學者去研究SmI2在消除反應中的應用.
3.1 碳-鹵鍵斷裂引發的β-消除反應
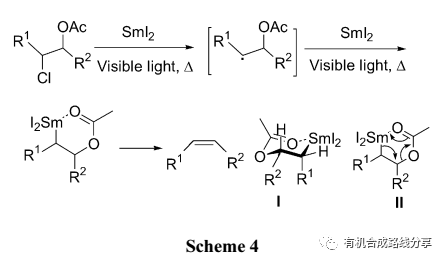
Concellón等[23]報道了氧乙酰化氯乙醇衍生物的β-消除反應, 未活化的C—Cl鍵在加熱和光照下發生金屬化作用得到碳自由基中間體, 然后碳自由基與SmI2 共用一對電子生成碳-釤金屬鍵. 當R1為烷基時, 三價的金屬釤和酯基上的羰基氧配位經過一個六元環狀過渡態消除得到產物, 而過渡態I為優勢構象所以消除產物以Z式為主(Scheme 4).
3.2 碳-硫鍵斷裂引發的β-消除反應
基于SmI2促進的β-消除反應很好的選擇性, Marko等[29]將其引入到Julia-Lythgoe烯化反應中, 改善了烯化反應的立體選擇性, 主要產物為E式結構, 有的反應的立體選擇性大于95∶1 (Eq. 20).
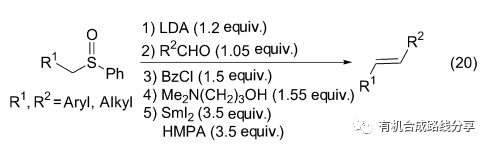
3.3 碳-氧鍵斷裂引發的β-消除反應
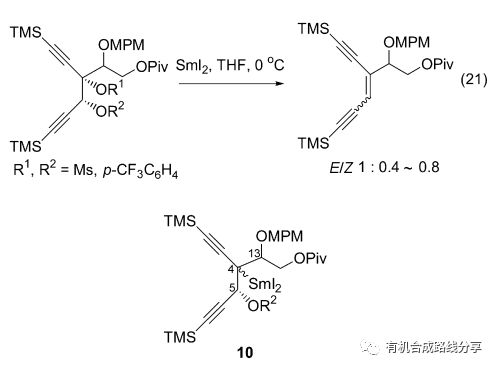
2008年Hirama等[30]報道了碳-氧鍵斷裂引發的β-消除反應(Eq. 21), 并將這一方法應用于C-1027 Chromophore的全合成. 該反應首先在4位碳上發生碳-氧鍵斷裂得到中間體10, 然后消除得到產物.

SmI2 促進的加成反應主要有自由基加成和親核加成兩種. SmI2是一種良好的單電子轉移試劑, SmI2釋放出1 equiv.電子引發碳-雜鍵的斷裂得到碳自由基, 若此時發生反應則為自由基加成; 碳自由基再得到1 equiv. SmI2 釋放出的電子便得到碳負離子, 若此時發生反應則為親核加成.
4.1 SmI2促進的自由基加成反應
在SmI2作用下, 可以引發羰基化合物C—O π鍵的斷裂生成羰基自由基, 也可以引發碳-氧單鍵和碳-鹵單鍵的斷裂得到其他自由基, 可以分別與α,β-不飽和化合物、烯炔、苯環等發生自由基加成反應.
4.1.1 烯烴的自由基加成反應
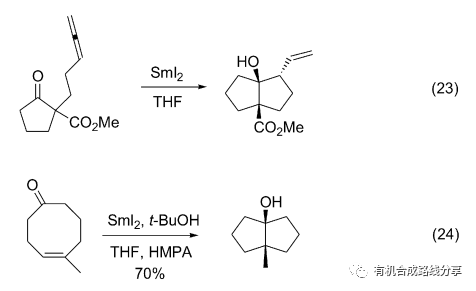
烯烴電子云密度較高很容易發生加成反應, 比如環加成反應、親電加成反應和自由基加成反應等. 文獻報道了很多SmI2 作用下醛酮和烯烴的自由基加成反應. Molander等[32]報道了醛酮和聯烯分子內自由基環化反應, 在羰基的α位引入酯基可以起到很好的立體控制作用(Eq. 23). 2007年他[33]還報道了大環分子內羰基和碳-碳雙鍵的自由基環化反應, 在反應中優先生成五元環(Eq. 24).
4.1.2 α,β-不飽和化合物的自由基加成反應
當烯烴的雙鍵碳上連接羰基、酯基、腈等吸電子基團即是我們通常所說的α,β-不飽和化合物. 它們是一類重要的合成原料, 可以發生多種反應, 比如Diels-Alder反應、加成反應等. 它們在SmI2引發的自由基加成反應中也有重要的應用。
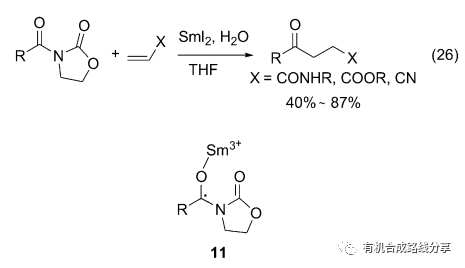
2005年Skrydstrup等[35]報道了在SmI2引發下N-酰基噁唑烷酮和α,β-不飽和酯、酰胺等反應得到了γ-羰基酯, 酰胺等化合物(Eq. 26), 這一方法克服了通常使用的酰基自由基容易發生去羰基化的缺點. 研究證實反應中會產生一個Sm3+配位的羰基自由基陰離子中間體11[36].
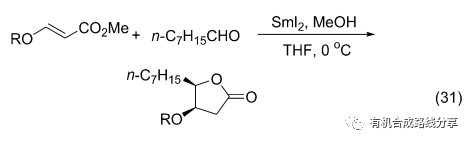
在SmI2引發下醛和β位烷氧取代的丙烯酸甲酯反應則生成五元環內酯(Eq. 31)[41], 但是產率較低(最高也只有52%).
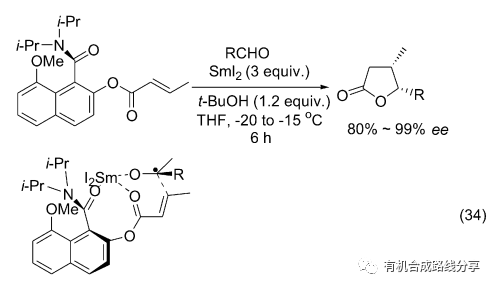
人們還對這一反應的不對稱合成作了研究. 戴偉民等[44]報道了遠端酰胺構象誘導的對映選擇性反應, 由于氮上兩個取代基的位阻較大致使氮原子并未和萘環處于同平面, 在萘環上酰基氧和Sm3+配位時偏離平面的N可以影響反應的選擇性(Eq. 34). 產物以cis式為主, 產率能達到90%, 而且ee值也能達到大于99%的水平.
4.1.3 芳環的自由基加成反應
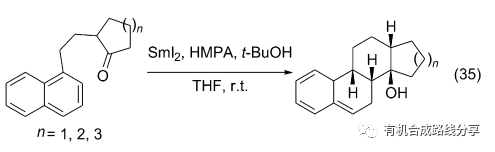
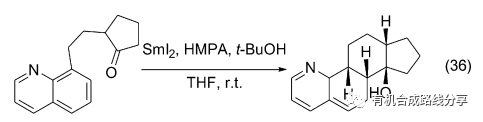
醛酮在SmI2作用下和苯、萘、苯并呋喃等芳香化合物反應可以得到多環化合物. Reissig等在報道了酮和苯環分子內自由基環化反應得到二環化合物后將這一反應擴展到三環和四環化合物的合成, 通常這些反應都有很好的立體選擇性(Eq. 35)[46]. 喹啉取代萘環時也能完成含氮三環或四環化合物的合成, 取得了較好的結果(Eq. 36)[47].
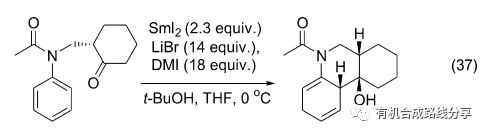
當底物中含有酰胺結構時, 反應過程中酰胺不受影響而只發生自由基加成反應(Eq. 37)[48] Reissig 等在研究中還發現在反應體系中加入一定比例的LiBr和DMI (1,3-dimethyl-2-imidazolidinone)可以取代有劇毒的HMPA在反應中起到相似的作用.
4.1.4 其他自由基加成反應
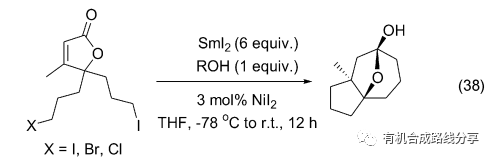
SmI2作為單電子轉移試劑釋放1 equiv.的電子引發碳-鹵鍵的斷裂, 失去鹵負離子產生碳自由基從而引發自由基加成反應. Jean 在研究中發現, 在SmI2 作用下C—Cl鍵和C—Br鍵活性低不足以引發反應進行, 而C—I鍵活性很高可以使反應順利進行(Eq. 38)[51].
4.2 SmI2促進的親核加成反應
4.2.1 Aldol反應
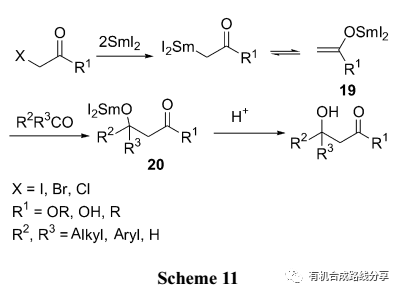
SmI2 促進的Reformatsky反應具有很廣泛的應用,近些年來人們對這些反應的機理, 選擇性和底物的適用范圍進行了深入的研究. 該反應主要經歷以下過程, 首先底物在2 equiv.的SmI2作用下失去鹵負離子生成烯醇鹽中間體19, 然后19再與親電試劑醛酮等反應得到化合物20, 它再奪取質子源中的氫便得到相應的β-羥基
化合物(Scheme 11).
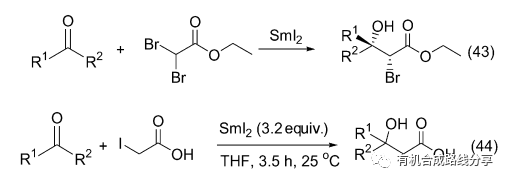
前面提到Concellon以α,α-二溴代酯和醛反應制備了α,β-不飽和酯, 后來他又以α,α-二溴代酯和酮反應制備了2-溴-3-羥基酯, 反應停留在Aldol縮合階段并未繼續發生消除反應(Eq. 43)[57]. 他還第一次報道了羧基存在下的Reformatsky反應(Eq. 44)[58]. 但是當以苯甲醛和碘代乙酸反應時得到的是吶醇偶聯產物而不是3-羥基乙酸, 其他醛酮則可以順利反應得到預想的產物.
4.2.2 其他反應
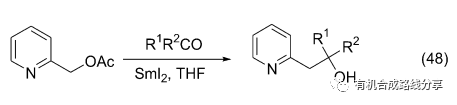
Helquist等[64]發現在底物中有氮原子配位的情況下可以促進乙酰氧基的離去, 然而在氮原子處于芳環其他位置或者芳環上不含氮原子的情況下不會生成預計的產物(Eq. 48).
5.1 碳族其他元素的聯結
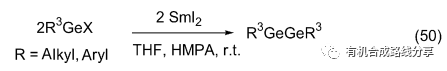
以鹵鍺烷合成鍺-鍺鍵需要溫和的還原試劑, 還原劑還原能力太強容易致使新生成的鍺-鍺鍵斷裂, 太弱則不能使反應發生. 由于SmI2 具有溫和的還原電勢為-1.55 V, 這使得它可以促進鹵化鍺(錫)之間發生反應得到乙鍺(錫)烷(Eq. 50)[66].
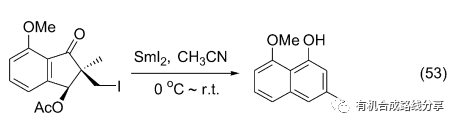
SmI2 還可以用于擴環反應以制備單取代或者多取代的萘酚(Eq. 53)[70], 在THF/HMPA溶劑體系中加入BF3?Et2O或者選用乙腈作為溶劑體系可以縮短反應時間和提高反應的轉化率.

SmI2 不僅可以作為單電子轉移試劑促進各種形成碳-碳鍵和碳-雜鍵的反應, 還可作為Lewis酸型的預催化劑像其他的Lewis酸型催化劑一樣催化碳-氮鍵和碳-碳鍵的形成.
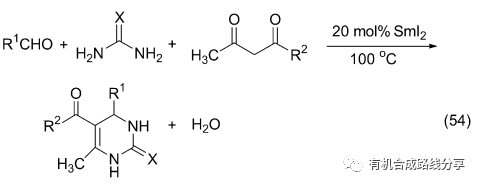
6.1 Biginelli反應
Biginelli反應是將醛、尿素(硫脲)和1,3-二酮混合在催化劑下以“一鍋法”縮合, 是合成二氫嘧啶酮的重要方法, SmI2 也可以作為Biginelli反應的催化劑(Eq. 54)[71]. 與其他Lewis酸催化劑相比, 具有用量小, 耗資少而且無需溶劑的優點. 有的反應也有很高的產率.
6.2 Aza-Diels-Alder反應
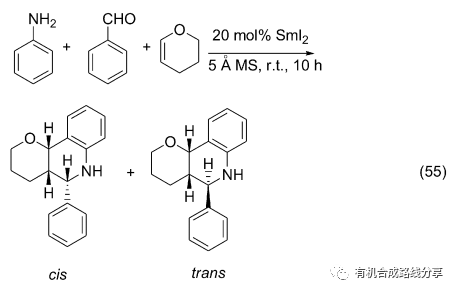
SmI2作為Lewis酸型催化劑也可以用于催化Aza- Diels-Alder反應. 在Diels-Alder反應中會產生cis式和trans 式兩種結構的產物, 沈琪等[72]報道的反應可以通過簡單的改變反應條件就能控制反應產物的比例, 比如在高溫且底物低濃度下產物以熱力學穩定的trans 式為主(Eq. 55).
6.3 Friedel-Crafts反應
Gil等[73]發現SmI2也可以催化Friedel-Crafts反應(Eq. 56), 在反應中酯基并未發生反應, 即使反應體系中少量水的存在對反應也不會產生影響.
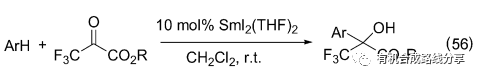
6.4 Aza-Michael反應
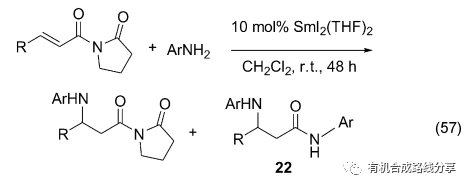
Collin等[74]報道了SmI2催化的Aza-Michael反應, 芳環上的推電子基團有利于反應的進行, 而且增大芳胺的用量產物以酰胺22為主(Eq. 57).
眾多實驗事實表明, 二碘化釤是一種應用廣泛的試劑, 既可以作為單電子轉移試劑促進各種還原偶聯反應, 也可以作為Lewis酸型的預催化劑催化各種反應. 大多數二碘化釤參與的反應都具有反應條件溫和、反應速度快、選擇性好(立體選擇性、對映和非對映選擇性)的優點. 基于這些優點未來幾年在二碘化釤促進的新反應方面也一定會有突破, 它在天然產物的合成中也定會繼續扮演重要的角色. 同時我國又是稀土大國, 釤的儲量非常豐富, 進一步研究二碘化釤在有機合成中的應用具有重要的經濟意義和現實意義.
聲明:
本文節選自Chin. J. Org. Chem. 2010,30, 939-950,版權和內容解釋權歸原作者所有。在這里僅供交流使用,如涉及版權問題,請聯系刪除








