吡啶類化合物是目前雜環化合物中開發應用范圍最廣的品種之一,作為一種重要的精細化工原料,其衍生物主要有烷基吡啶、鹵代吡啶、氨基吡啶、溴吡啶、甲基吡啶、碘吡啶、氯吡啶、硝基吡啶、羥基吡啶、芐基吡啶、乙基吡啶、氰基吡啶、氟吡啶、二氫吡啶等,其中農藥占毗咤系列產品消費總量的50%左右;飼料添加劑約為30%;醫藥及其他領域占20%。
吡啶的重要衍生物有煙酸、煙酰胺、異煙酰肼、煙堿、馬錢子堿、維生素B6等。吡啶具有接近正六角形的結構,與苯相似,具有相同的電子結構。由于環中氮原子的吸電子作用,使2,4,6位上電子云密度低于3,5位,在酸性介質中,親電取代反應發生在3,5位,親核反應如胺化、烷基化、芳基化、酰化發生在2,4,6位。吡啶是一種弱的叔胺,在乙醇溶液中能與多種酸(如苦味酸、高氯酸等)形成不溶于水的鹽;由于吡啶呈堿性,能與鹽酸生成吡啶鹽酸鹽(C5H5N·HCl)。在鎳催化劑作用下,在200℃及15~30MPa下,加氫還原,可生成哌啶;也可電解還原為哌啶;它的還原性較苯容易。吡啶較苯難氧化,但用過氧化氫或過氧酸可將吡啶氧化生成N-氧化吡啶,這是一個重要的吡啶衍生物,因氮原子氧化后,不能形成帶正電荷的吡啶離子,有利于芳基的親電取代反應。吡啶的親電取代如硝化、磺化、鹵化都較困難,但鹵化較前二者稍易,在200℃以上,可得 3,5-二氯吡啶,或3,4.5-三氯吡啶。吡啶能與多種金屬離子形成結晶性的配位化合物。
點擊題目查看詳細內容。
一、Boekelheide反應
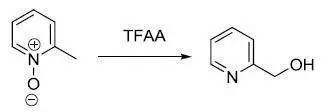
2-甲基吡啶氮氧化物用三氟乙酸酐或乙酸酐處理得到2-羥甲基吡啶的反應。
二、Boger吡啶合成反應
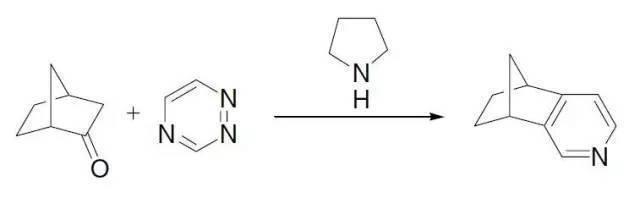
1,2,4-三氮唑和親二烯體(如烯胺)通過雜原子D-A加成脫去N2得到吡啶的反應。
三、Chichibabin吡啶合成反應
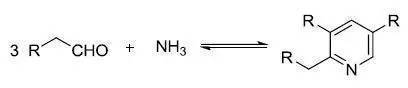
醛和氨縮合制備吡啶的反應。
四、Chichibabin反應
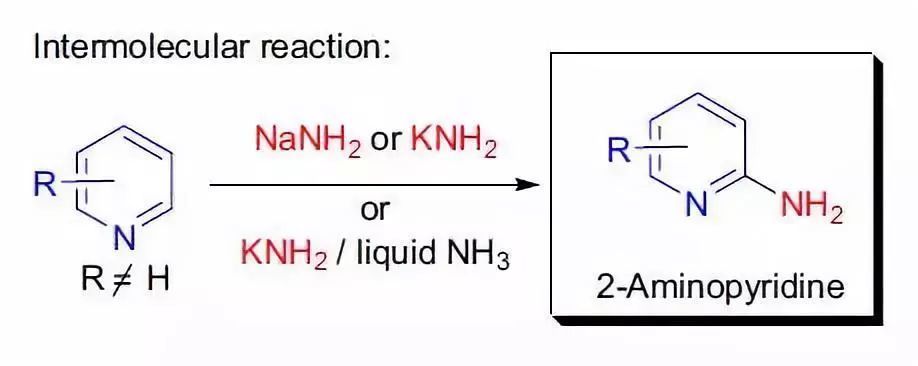
20世紀早期,A.E. Chichibabin利用吡啶和氨基鈉在二甲胺中高溫(110 °C)下反應,用水后處理后,以80%的收率得到2-氨基吡啶。十年后,在320 °C下,他將吡啶加入到KOH粉末中,用水后處理后得到2-羥基吡啶。與此類似的,吡啶及其衍生物與強親核試劑,如烷基或芳基鋰,反應可以得到2位的烷基或芳基吡啶。
五、Ciamician–Dennstedt重排
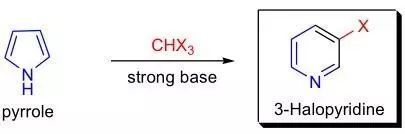
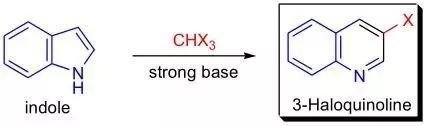
吡咯在強堿條件下與鹵仿(CHX 3 where X = Cl, Br, I)反應重排生成 3-鹵代吡啶的反應。此反應是由G.L. Ciamician在1881年首先發現,后來M.Dennstedt 利用甲醇鈉催化吡咯和二碘甲烷反應制備得到吡啶,使此方法的應用范圍更加廣泛。后來在此研究的基礎上,利用吲哚和喹啉的方法也被發現。因此此類反應都統稱為Ciamician-Dennstedt重排反應。
六、Hetero-Diels–Alder reaction(雜-Diels–Alder反應)
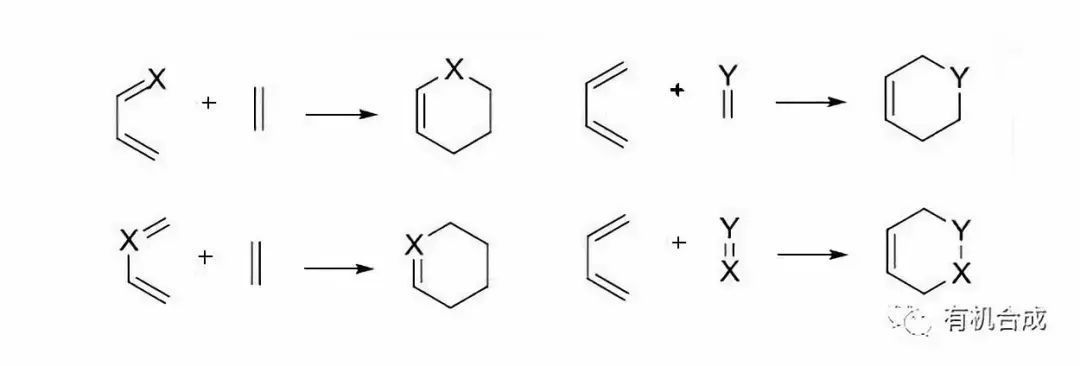
雜二烯體和親二烯體(或者雜親二烯體和二烯體)進行Diels–Alder反應得到六元雜環的反應。最常見的是氮雜Diels–Alder反應和氧雜Diels–Alder反應。
七、Guareschi–Thorpe縮合
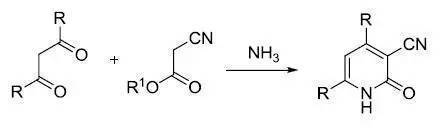
氰基乙酸酯和1,3-二酮在氨存在下縮合制備2-吡啶酮的反應。
八、Hantzsch二氫吡啶合成法
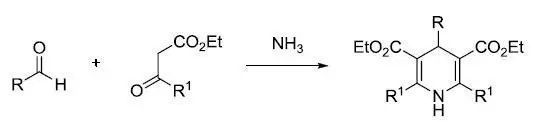
醛,β-酮酯和氨縮合得到1,4-二氫吡啶的反應。Hantzsch1,4-二氫吡啶在有機催化反應中是非常常用的還原劑。得到二氫吡啶衍生物,再用氧化劑(亞硝酸或鐵氰化鉀)氧化得到吡啶衍生物。這是一個用于合成吡啶同系物很普遍的反應。
九、Kr?hnke吡啶合成
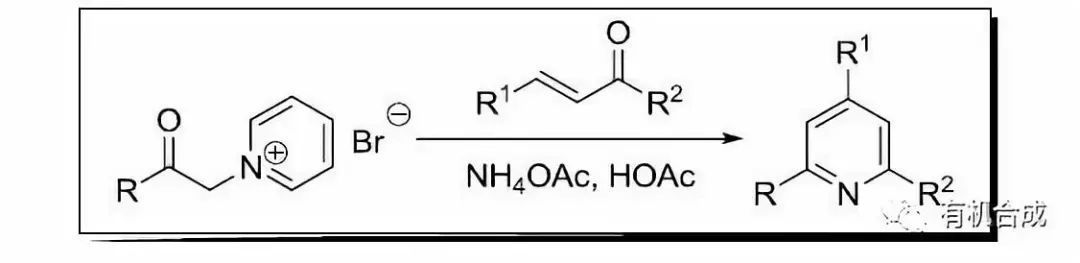
由α-吡啶基甲基酮鹽和α,β-不飽和酮反應制備吡啶的方法。
十、Zincke反應
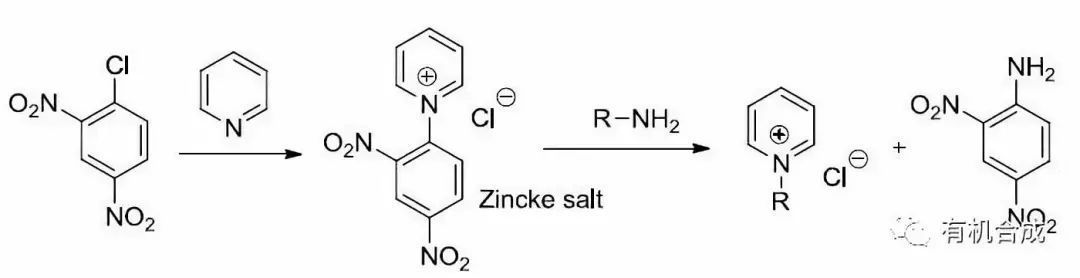
N-(2,4-二硝基苯基)吡啶鹽( Zincke鹽)與苯胺或脂肪胺作用進行胺交換生成相應的N-芳基或N-烷基吡啶鹽的反應。
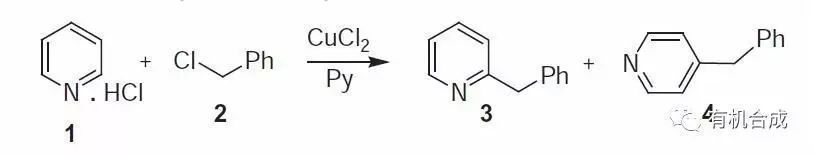
銅鹽作用下,吡啶和芐基鹵代物反應得到2位或4位芐基化產物的反應。其他的一些烷基鹵代物也可以進行此反應,但產率不高。
十二、Kaiser-Johnson-Middleton二腈環化反應
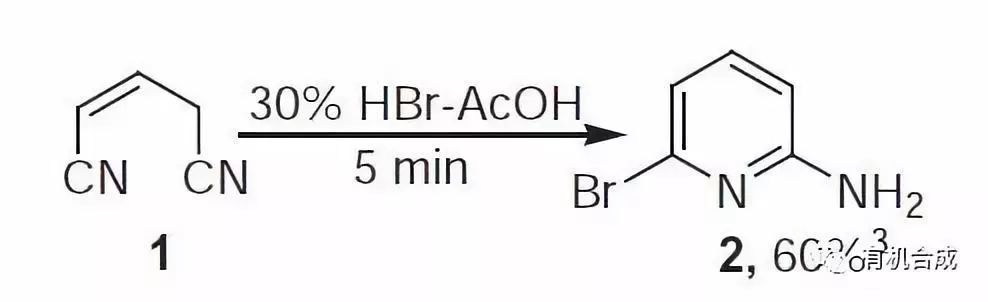 HBr作用下,二腈關環合成溴取代的五元,六元或七元環雜環的反應。合成吡啶。
HBr作用下,二腈關環合成溴取代的五元,六元或七元環雜環的反應。合成吡啶。
十三、Baeyer吡啶合成反應
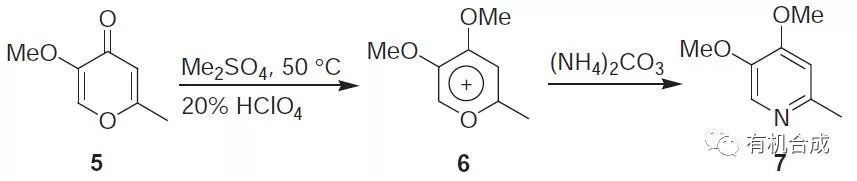
吡喃酮和胺(氨)關環合成吡啶的反應。
十四、Hammick吡啶烷基化反應
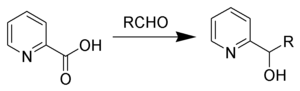
2-吡啶甲酸加熱脫羧后對羰基化物進行親核加成得到2-吡啶甲醇的反應。
十五、Michaelis-Nylen吡啶膦酸化反應
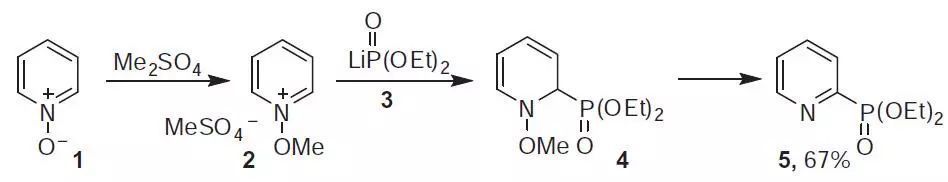
膦酸二烷基酯鋰鹽親核進攻吡啶-N-氧化物得到二位吡啶膦酸二烷基酯的反應。類似反應Michaelis-Arbuzov膦酸酯合成。
十六、稠環吡啶
常見的喹啉合成反應
常見的異喹啉合成反應








