今天給大家分享一篇angew上的文章Sequence-Based Prediction of Promiscuous Acyltransferase Activity in Hydrolases,本文通訊作者是來自格賴夫斯瓦爾德大學(xué)的Uwe T. Bornscheuer教授,其課題組研究方向?yàn)榛诶硇栽O(shè)計(jì)、定向進(jìn)化等手段的蛋白質(zhì)工程。

在水溶液中,水通常充當(dāng)親核試劑,導(dǎo)致酯或脂質(zhì)的水解。一些水解酶在無水的有機(jī)溶劑環(huán)境下仍能保持活性,催化酰胺或酯的形成。一些水解酶甚至能在大量水的存在下催化酰基轉(zhuǎn)移。和自然中沒有水解酶活性的CoA依賴的酰基轉(zhuǎn)移酶不同,這類混雜的酰基轉(zhuǎn)移酶可以同時(shí)水解酰基供體與酰基化中間產(chǎn)物,因此高轉(zhuǎn)化率只能由動力學(xué)控制的反應(yīng)來實(shí)現(xiàn)。因水解反應(yīng)產(chǎn)物熱力學(xué)更穩(wěn)定,通常這些酶的酰基化產(chǎn)物都只能暫時(shí)積累,最終一部分產(chǎn)物水解后因?yàn)樗峄姑甘Щ睿瑥亩_(dá)到一個(gè)平衡。作者此前的研究發(fā)現(xiàn)了一些這類混雜的酰基水解酶,在本研究中希望發(fā)現(xiàn)這類酶的分子機(jī)理,進(jìn)而通過序列來進(jìn)行預(yù)測。
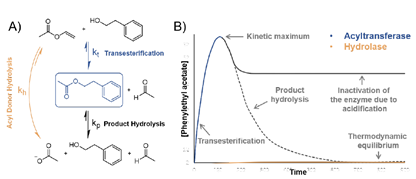
作者解析了bHSL家族中混雜的酰基水解酶Est8的結(jié)構(gòu),發(fā)現(xiàn)其底物結(jié)合口袋有一個(gè)通道,其中含有Ser-Glu-His催化位點(diǎn)。并且這個(gè)通道由于一些甲硫氨酸殘基高度疏水。作者假設(shè)活性位點(diǎn)的疏水性為Est8的酰基轉(zhuǎn)移酶活性起到了重要作用。bHSL家族中cap domain形成了底物結(jié)合口袋中最重要部分,由于其高度可變,作者假設(shè)bHSL活性位點(diǎn)的疏水性可以由其氨基酸序列推測。據(jù)此作者發(fā)展了針對bHSL的基于序列的疏水性打分系統(tǒng)。作者使用了氨基酸的疏水性打分表,其中疏水性殘基為正值,極性和帶電殘基為負(fù)值充當(dāng)懲罰,將cap domain的所有氨基酸之和作為打分。為了驗(yàn)證這個(gè)打分系統(tǒng)的合理性,作者分析了其它5個(gè)bHSL家族蛋白的結(jié)構(gòu),發(fā)現(xiàn)疏水口袋表面積與疏水性打分有很好的相關(guān)。作者又測定了這些酶的酰基化催化產(chǎn)物量,發(fā)現(xiàn)比Est8打分低的酶酰基化產(chǎn)物產(chǎn)量更低,打分相同的酰基化產(chǎn)量相近,而打分高的酶則酰基化產(chǎn)物明顯更多。作者也發(fā)現(xiàn)不同的醇對酰基轉(zhuǎn)移酶活性影響很大,通常苯甲醇比2-苯乙醇反應(yīng)活性更高。

作者為了拓展這個(gè)打分算法的應(yīng)用,使用BLAST找到了20000條序列并根據(jù)序列長度等方面選擇其中6500條計(jì)算打分。因?yàn)榈痛蚍值拿铬;D(zhuǎn)移酶活性較低,而高打分的酶在水溶液中可能因?yàn)槭杷砻姹┞抖a(chǎn)生聚集,影響催化效果,因此作者假設(shè)疏水性打分前1/4-1/2的酶具有較好的酰基轉(zhuǎn)移酶活性,據(jù)此篩選出的一些酶也具有較好的酰基轉(zhuǎn)移酶活性,這些酶很可能成為化學(xué)合成中的工具。同時(shí)作者也確實(shí)觀察到cap domain很疏水的酶穩(wěn)定性不佳,活性很容易喪失。
本文作者:JGG
原文鏈接:https://www.onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202003635
原文引用:DOI:10.1002/anie.202003635








