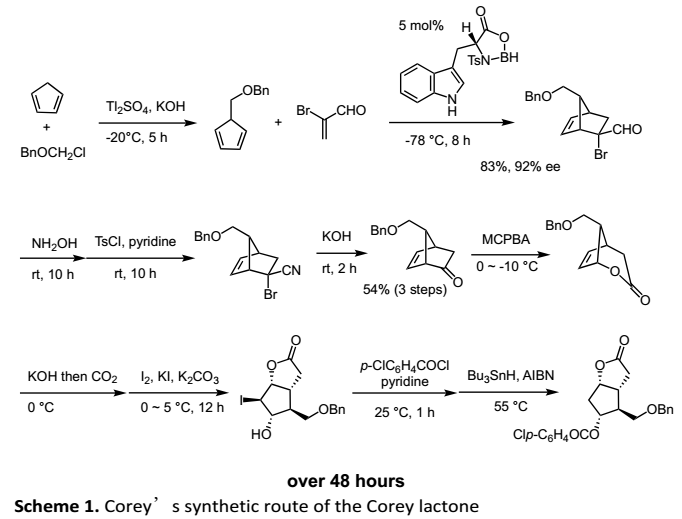
對于理想的合成,需要具有原子經濟性、步驟經濟性和氧化還原經濟性等。近日,日本東北大學Yujiro Hayashi課題組提出了“操作經濟性(pot economy)”的概念。如今,“一鍋法”合成不僅可以立體選擇性構建分子的關鍵結構片段,還可以進行越來越多的化學轉化。此外,“一鍋法”合成通過原位淬滅規避了多個純化步驟,從而最大程度地減少了化學廢物的產生并節省了時間。因此,“一鍋法”操作不僅合成效率高,而且對環境也友好。Corey內酯在合成中具有重要價值,但其合成方法通常涉及多個步驟、非常耗時。Stork課題組從順式環戊烯-1,4-二醇合成需要7個步驟;Woodward課題組從順式環己烷-1,3,5-三醇合成需要11個步驟。Corey課題組以手性Lewis酸催化的不對稱Diels-Alder反應作為關鍵步驟完成了Corey內酯的合成(Scheme 1)。Doyle課題組報道了手性銠催化劑介導的重氮乙酸酯的C-H插入用于Corey內酯的關鍵中間體合成;最近,陳芬兒課題組報道了催化不對稱Baeyer-Villiger氧化的動力學拆分。Corey報道的方法雖然實用,但需要10個步驟且耗時長(48 h,不包括純化時間)。因此,從市售的原料開始,通過短時間內在單個容器進行更有效的不對稱催化合成仍然充滿挑戰。近日,Yujiro Hayashi課題組以新優化的有機催化劑介導的不對稱[3+2]環加成反應作為關鍵步驟開發了一種實用且高收率的Corey內酯合成方法,該成果發表于近期Chem. Sci.(DOI: 10.1039/C9SC05824A)。
(圖片來源:Chem. Sci.)
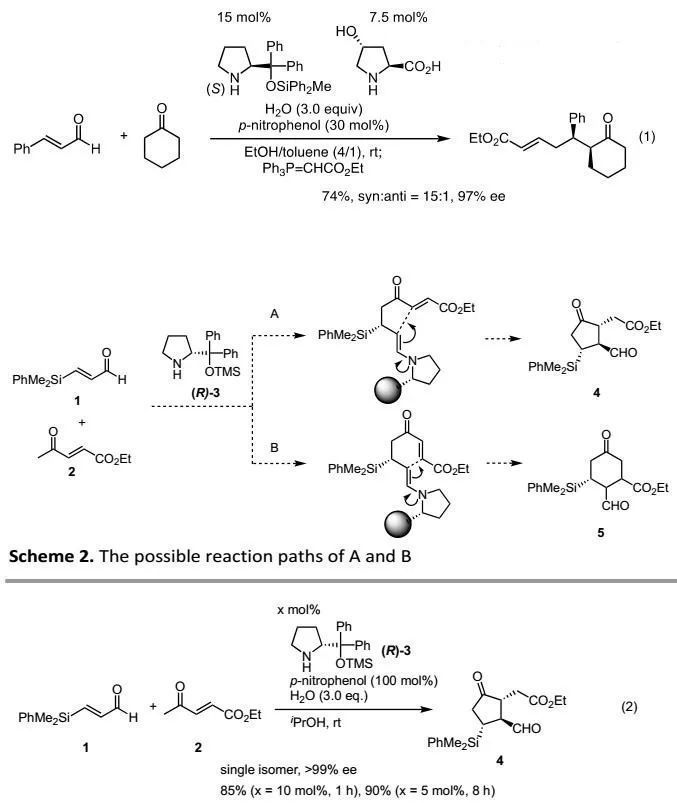
此前,作者已經報道了由兩種胺催化劑(即(S)-二苯基脯氨醇甲硅烷基醚和4-羥基脯氨酸)催化的環己酮和α,β-烯醛之間的不對稱Michael加成反應(Eq. 1)。基于酮可以作為Michael供體,作者設計了3-(二甲基苯基甲硅烷基)丙烯醛(1)和4-氧代-2-戊烯酸乙酯(2)的串聯Michael/Michael加成反應。首次Michael加成之后,存在兩種可能的途徑(Scheme 2):首次Michael加成產生烯胺后,可能通過5-exo模式與α,β-不飽和酯反應得到4;也可能通過6-endo模式與α,β-不飽和酮反應得到5。經過幾次研究,作者只觀察到環戊酮衍生物4,未發現環己酮5(Eq. 2)。
(圖片來源:Chem. Sci.)
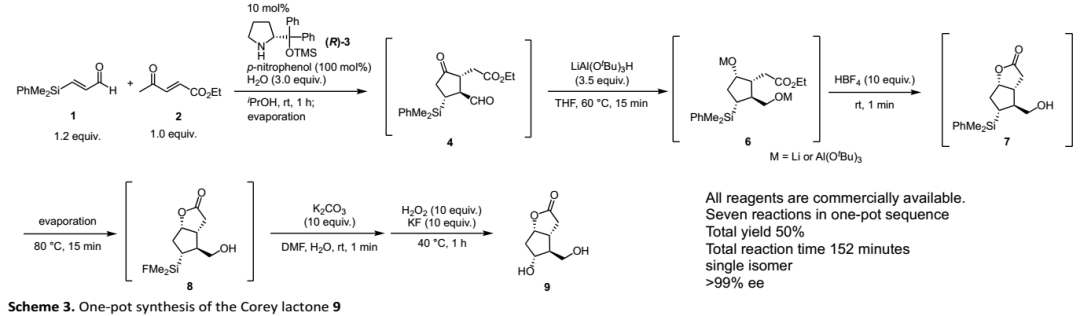
作者還發現,不需要胺催化劑,僅在(R)-二苯基脯氨醇硅醚(R)-3和對硝基苯酚存在下,即可進行串聯Michael/Michael加成,并以良好的收率和優異的對映選擇性得到環戊酮4,成功建立三個連續手性中心。得到Corey內酯的環戊酮母核后,作者進一步研究了Corey內酯的 “一鍋法”合成。由于涉及幾種不相關的反應,如不同條件下的還原和氧化反應,以及殘留的試劑也可能干擾后續反應,因此,在同一反應器中進行多個轉化(如醛的還原、酮的立體選擇性還原、內酯化和Tamao-Fleming氧化用于將C-Si鍵轉化為C-O鍵)充滿挑戰。通過嚴格的條件篩選后,作者最終完成了快速“一鍋法”連續合成(Scheme 3)。作者以市售的起始原料1和2在單個容器內僅用152 min便以50%的總收率完成了Corey內酯(9)的全合成。
(圖片來源:Chem. Sci.)
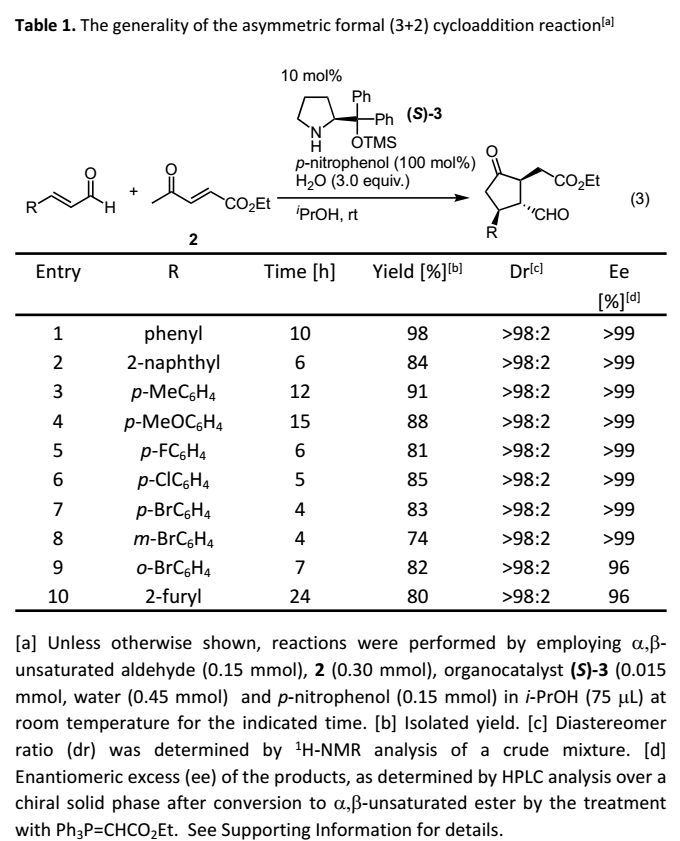
這種“一鍋法”合成涉及兩個反應步驟組成的串聯反應:1)酮和α,β-烯醛的不對稱Michael加成,2)連續的分子內Michael加成;以及后續五個反應步驟,包括:3)醛的還原,4)酮的立體選擇性還原,5)內酯的形成,6)Si-Ph鍵轉化為Si-F鍵以及7)C-SiMe2F轉化為C-OH鍵。此外,HBF4從中發揮了四重作用:1)還原后,將O-Li或O-Al鍵轉化為O-H鍵,2)促進過量LiAlH(t-BuO)3的分解,3)促進內酯7的形成,4)將Si-Ph鍵轉化為Si-F鍵。單一試劑在多步反應中發揮各種作用的能力構成了“一鍋法”的特征。最后,作者研究了關鍵的串聯反應的通用性,即α,β-不飽和醛與4-氧代-2-戊烯酸乙酯(2)的[3+2]環加成(Table 1)。首先,自主在最佳反應條件下考察了肉桂醛的反應,但其反應效率差。經過條件優化,在對硝基苯酚存在下,底物可以優異的收率(98%)和對映選擇性(>99% ee)得到單一異構體產物。接下來,作者研究了反應的通用性:對于α,β-不飽和醛的β-取代基,不僅苯基和2-萘基,其他富電子芳香化合物如對甲苯基和對甲氧基苯基也適用;缺電子芳香化合物如對氟、對氯、對溴苯基和間溴、鄰溴苯基以及呋喃基也是合適的取代基。在所有情況下,底物均可以優異的非對映選擇性和對映選擇性得到手性取代環戊酮。
(圖片來源:Chem. Sci.)
Yujiro Hayashi課題組利用市售的原料在同一反應容器內用時152 min便以優異的收率完成了Corey內酯的不對稱全合成。其關鍵在于通過二苯基脯氨醇硅醚介導的α,β-烯醛和4-氧代-2-戊烯酸乙酯(2)的串聯Michael/Michael加成得到的三取代環戊酮為單一異構體,構建起三個連續的手性中心;然后,通過 “一鍋法”還原內酯化-氧化快速完成其全合成。鑒于有機催化劑介導的不對稱[3+2]環加成具有廣泛的通用性,高度官能團化的環戊酮衍生物是多種天然產物和藥物合成的有用的手性中間體。








