分享一篇發表在Nature Chemical Biology上的文章:Monitoring in real time and far-red imaging of H2O2 dynamics with subcellular resolution,通訊作者是來自華盛頓大學的Andre Berndt教授,該課題組致力于開發用于實時檢測生化信號的熒光生物傳感器。

氧化應激是許多疾病進程的關鍵因素之一,而過氧化氫(H2O2)作為哺乳動物生物學中的關鍵氧化劑以及生理水平上的多效性信號分子,在細胞氧化還原調控中起著重要作用。細胞內H2O2的水平通常受到嚴格的調控,其過度積累常常與細胞還原能力下降一起成為常見的病理標志。為了更好地理解H2O2在氧化還原生物學中的作用,能夠實時監測H2O2與關鍵生物相互作用分子的動態變化至關重要。
在這項研究中,作者將細菌OxyR H2O2傳感器與基于羅丹明-HaloTag的化學報告系統結合起來,開發了一種遠紅外H2O2傳感器,命名為帶有Janelia Fluorophore 635 的 HaloTag 光遺傳過氧化氫傳感器(JF635;oROS-HT635)。
首先,作者考慮報告基團的插入位置,根據從實驗解析的結構和計算模型中獲得的結構信息,開發了一種合理的工程化策略。該策略旨在保持衍生傳感器中驅動傳感結構域(ecOxyR-LBD)的靈活性。簡而言之,ecOxyR包含一個疏水袋,它是H2O2相互作用的活性中心,其中H2O2與相鄰殘基形成氫鍵網絡,使殘基C199和C208靠近,形成二硫橋。通過分析ecOxyR-LBD結構的B因子,作者觀察到在199-208區域有一個明顯的高柔性峰。作者推斷,要使OxyR被H2O2有效激活,就必須保持這種靈活性。因此,在C199和C208之間插入一個笨重的熒光報告基團可能會導致 OxyR 激活速度減慢,因此作者后續考慮該區域之外的其他位點。
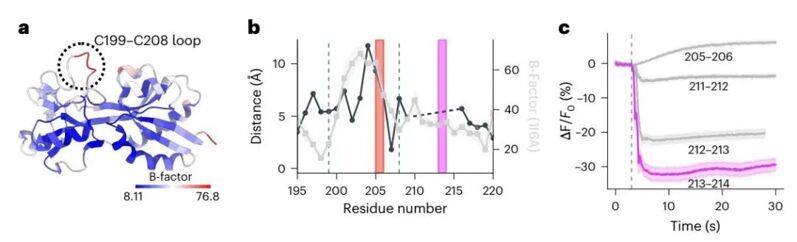
于是作者嘗試將cpHaloTag插入ecOxyR中C199-C208環外的多個位置后,與插入205-206的傳感器相比,ecOxyR對300 μM H2O2的響應速度加快。通過結構分析,作者確定了213-214是最優的JF635插入位置。進一步地,作者通過域間連接體殘基的隨機突變(XX-cpHaloTag-X,其中X表示突變目標),發現了一個變體(TG-cpHaloTag-R)的靜態亮度增加了8.9倍,動態范圍增加了27%,命名為oROS-HT635。
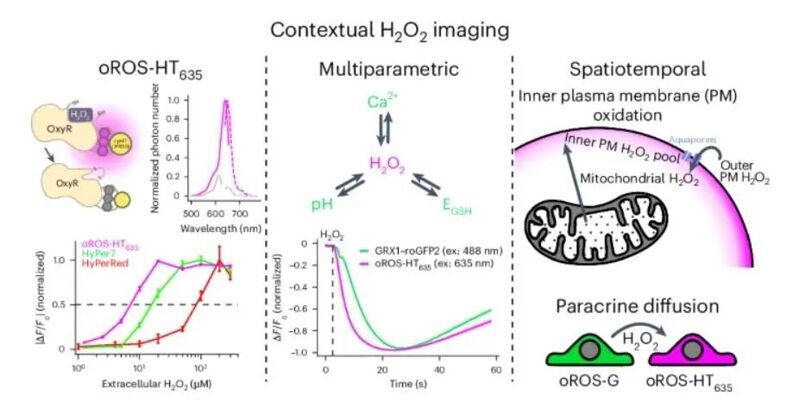
作為概念驗證,作者還研究了抗炎劑auranofin對HEK293細胞中H2O2水平的急性影響,以及細胞氧化還原電位或人誘導多能干細胞衍生心肌細胞(hiPS 細胞-CMs)中Ca2+水平的變化,證明了該傳感器的功能。最后,作者還介紹了可視化特定位點H2O2生成以及從線粒體和外質膜向內質膜、鄰近細胞擴散的驗證。
綜上所述,本文作者開發了oROS-HT635 傳感器,為在生理和病理條件下研究H2O2的作用提供了一個重要的工具,有助于深入理解細胞氧化還原調控的機制以及H2O2在細胞生理過程和疾病發生發展中的作用。
本文作者:MB
責任編輯:LZ
DOI:10.1038/s41589-025-01891-7
原文鏈接:https://doi.org/10.1038/s41589-025-01891-7








