作為有機化學(xué)的經(jīng)典人名反應(yīng),陰離子Brook重排已被廣泛的應(yīng)用于有機合成中(圖1a)。相比之下,自由基Brook重排由于在溫和條件下可控生成和操縱烷氧基自由基的困難,相關(guān)研究顯著較少并且涉及自由基Brook重排的對映選擇性交叉偶聯(lián)反應(yīng)仍未見報道(圖1b)。與此同時,α-芳基-α-三氟甲基醇作為藥物分子的重要結(jié)構(gòu)單元,其傳統(tǒng)的合成方法通常依賴于雙電子的過程(如羰基化合物的親核加成)。而Bandini團隊報道了鎳催化芳基鹵化物與α-氧烷基自由基交叉偶聯(lián)合成α-芳基-α-三氟甲基醇的唯一實例,但ee值僅為7%(圖1c)。
本文提出了一種創(chuàng)新策略,通過首次將光催化自由基Brook重排應(yīng)用于對映選擇性交叉偶聯(lián)反應(yīng),實現(xiàn)了手性氟代烷基醇的不對稱合成(圖 1d)。該催化體系具有優(yōu)異的官能團耐受性和對映選擇性控制(高達99% ee)。機理研究表明,有機硅試劑芳環(huán)上的供電子甲氧基取代基通過降低氧化電位,對自由基Brook重排至關(guān)重要。
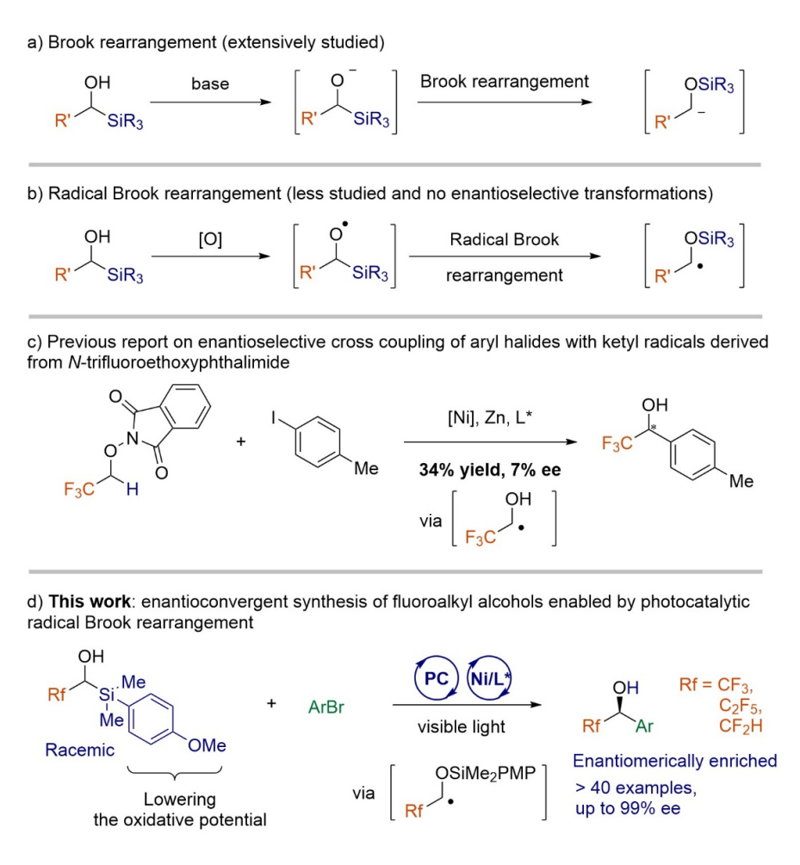
圖1. 研究背景與沈曉課題組手性氟烷基醇的研究成果
本文創(chuàng)新性的首次將光催化自由基Brook重排應(yīng)用于鎳催化的交叉偶聯(lián)反應(yīng)中。通過循環(huán)伏安曲線研究表明在α-硅基-α-三氟甲基醇中引入甲氧基苯,降低底物的氧化電勢,是該反應(yīng)成功的關(guān)鍵(圖2a)。通過對配體優(yōu)化,該工作能以優(yōu)異的產(chǎn)率和對映選擇性實現(xiàn)α-氟烷基醇的立體匯聚式合成(圖2b)。
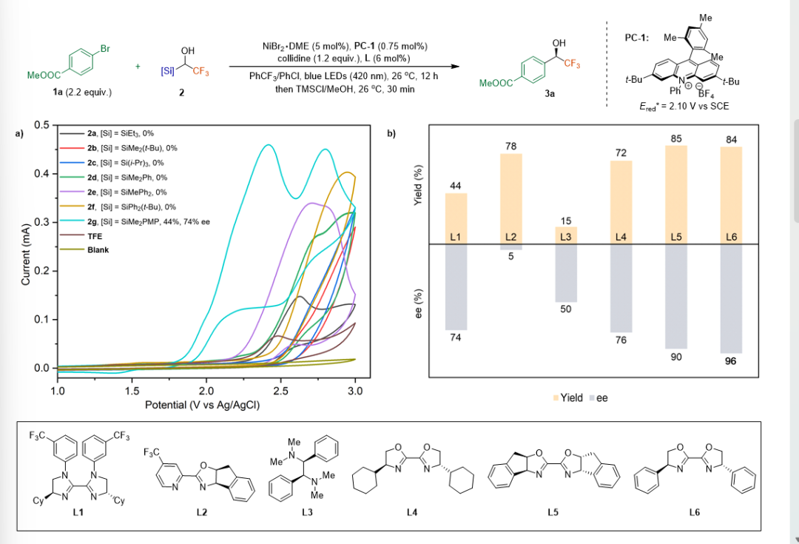
圖2. 條件優(yōu)化
基于機理實驗的結(jié)果,作者對于該反應(yīng)提出了可能的反應(yīng)機理:在藍光照射下,基態(tài)的PC-1 轉(zhuǎn)變?yōu)榧ぐl(fā)態(tài)PC-1*,激發(fā)態(tài)PC-1*與2g 發(fā)生單電子轉(zhuǎn)移,生成相應(yīng)的芳烴自由基陽離子中間體I。然后在堿的存在下,芳烴基陽離子中間體I 通過多位點質(zhì)子耦合電子轉(zhuǎn)移(MS-PCET)和自由基Brook生成自由基中間體III。生成的烷基自由基III 被Ni(0)捕獲形成Ni(I)中間體IV,然后與芳基溴化物進行氧化加成形成Ni(III)物種V。還原消除反應(yīng)生成交叉偶聯(lián)的產(chǎn)物3’和Ni(I)中間體VI。Ni(I)被PC-1 還原為Ni(0),并繼續(xù)參與催化循環(huán)。同時,通過機理實驗可以排除Ni(0)與芳基溴化物氧化生成Ni(II)中間體VII,然后捕獲烷基自由基中間體III形成Ni(III)中間體V的反應(yīng)路徑(圖3)。
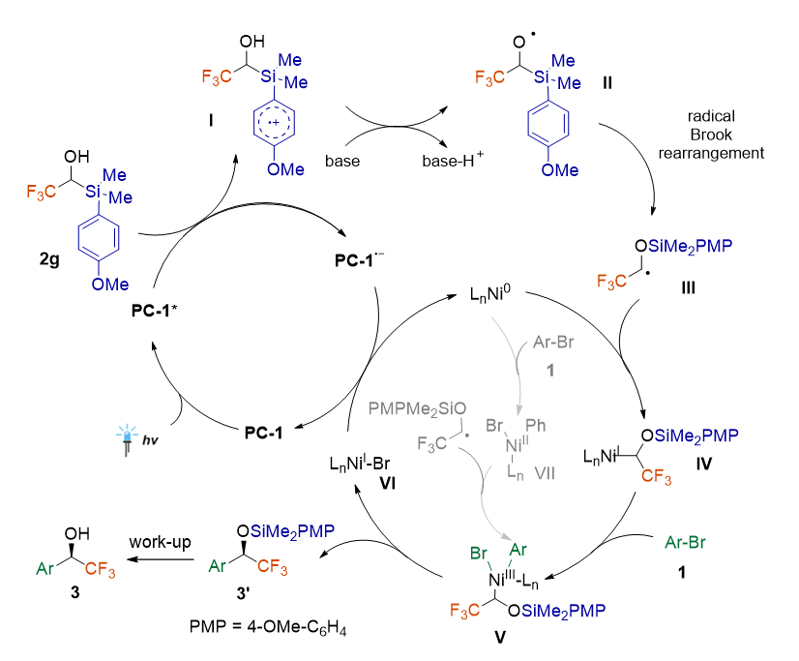
圖3: 可能的機理
在該工作中,沈曉課題組通過光催化自由基Brook重排實現(xiàn)了氟烷基醇的立體匯聚式合成。該反應(yīng)不需要在底物中預(yù)裝羰基,使用來源廣泛的芳基溴代物作為親電試劑,為對映選擇性的合成氟烷基醇化合物提供了新的策略和解決方法。反應(yīng)使用的鎳催化劑廉價易得、底物適用范圍廣泛,反應(yīng)條件溫和,產(chǎn)物的應(yīng)用轉(zhuǎn)換和放大量反應(yīng)證明了該反應(yīng)在合成化學(xué)中有廣泛的應(yīng)用潛力。值得注意的是,本研究首次將自由基Brook重排應(yīng)用于催化不對稱交叉偶聯(lián)反應(yīng)中。這一策略將為探索Brook重排在不對稱催化中的應(yīng)用開辟新途徑,并推動自由基介導(dǎo)的對映選擇性轉(zhuǎn)化的進一步發(fā)展
論文信息
Enantioconvergent Synthesis of α-Fluoroalkyl Alcohols Enabled by Photocatalytic Radical Brook Rearrangement
Yunhong Niu, Chenyu Jin, Xiaoqian He, Shenna Deng, Gang Zhou, Dr. Shanshan Liu, Prof. Dr. Xiao Shen
Angewandte Chemie International Edition
DOI: 10.1002/anie.202507789








