推薦一篇發(fā)表在JACS上的文章,題目為“Macrocyclic Phage Display for Identification of Selective Protease Substrates”,通訊作者是來自斯坦福大學Matthew Bogyo與Marta Barniol-Xicota,他們課題組的研究方向是多肽藥物及探針開發(fā)和化學蛋白質(zhì)組學。

蛋白酶在正常細胞功能以及許多病理狀況中起著至關重要的作用。因此,它們是治療和診斷藥物的寶貴靶標。對于大多數(shù)應用,需要高選擇性底物來區(qū)分目標蛋白酶和具有相似活性位點結構的同源酶。在已有的篩選底物肽的方法中,噬菌體展示技術以其極高的通量脫穎而出,但目前大多數(shù)的應用集中在線性底物的篩選中,其構象的多變性使得其容易發(fā)生脫靶蛋白水解,所以本文作者希望發(fā)展一種環(huán)肽的噬菌體展示篩選技術來選擇性地篩選蛋白酶的特異性水解底物。

作者利用1,5-二氯-2,4-戊二酮(DPD)對噬菌體pIII外殼蛋白上的線性肽(AACX?CG序列)進行共價環(huán)化,形成環(huán)肽結構。之后,二酮官能團與蛋白酶底物接頭的末端肼發(fā)生正交的Knorr-吡唑環(huán)化,即可形成最終的大環(huán)蛋白酶底物文庫。研究者可以更換肼連接的不同官能團來實現(xiàn)不同蛋白酶的底物篩選,如將脯氨酸識別位點連接到肼片段上即可靶向人成纖維細胞活化蛋白α(FAPα)和二肽基肽酶-4(DDP4),之后串聯(lián)生物素標簽即可實現(xiàn)對噬菌體展示文庫的富集和鑒定,串聯(lián)熒光報告基團即可讀出蛋白酶引發(fā)的酰胺鍵斷裂。具體而言,就是只有靶向相應氨基酸連接臂的蛋白酶才可以將環(huán)肽從鏈霉親和素的固相載體上釋放下來,利用蛋白酶切割特定序列的作用將與蛋白酶有特異性親和力的環(huán)肽釋放下來測序從而讀出目標環(huán)肽。
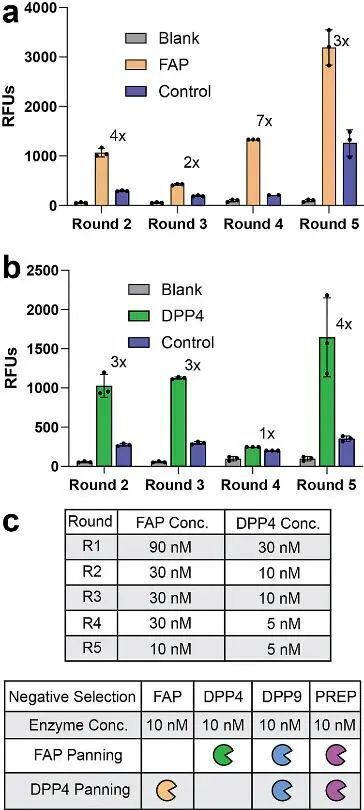
之后,作者希望將這種方法應用在蛋白酶特異性的底物環(huán)肽篩選上。作者針對序列同源性達68%的S9蛋白酶家族(含F(xiàn)APα、DPP4、DPP9、PREP)進行了五輪漸進式篩選,首先通過將各個蛋白酶濃度從90 nM(FAP)和30 nM(DPP4)逐輪降至10 nM(FAPα)和5 nM(DPP4),施加動力學壓力篩選出了高親和力底物。通過富集分析,作者將FAPα的底物分為6類結構簇,DPP4底物歸為7類結構簇。最后作者合成了對于這些酶有特異性親和力的環(huán)肽分子,并篩選得到了FAPα有特異性親和力的FAP-33環(huán)肽和對DPP4有特異性親和力的DPP4-10s環(huán)肽,相對于商業(yè)化的蛋白酶指示劑展現(xiàn)出顯著更強的特異性。
總之,本文發(fā)展了一種蛋白酶環(huán)肽底物的噬菌體展示平臺,可以高通量地用于蛋白水解酶的特異性環(huán)肽底物,對于多肽藥物及探針的發(fā)展具有重要啟示意義。
本文作者:LYC
責任編輯:MB
DOI:10.1021/jacs.5c04424
原文鏈接:https://doi.org/10.1021/jacs.5c04424








