原料藥中間體生產場地轉移如何實現
——中間體生產場地轉移問題的討論
討論場景:藥品生產企業A有一個非無菌仿制化學原料藥,總共5步合成反應,目前已批準。現由于種種原因,希望將前3步反應增加不同生產地址的另一個生產場地來生產,并且增加的生產場地屬于B公司。問,該如何申報這個轉移?
第一個前提,企業的訴求: 為什么要轉移生產場地,理由太多就不多說了。剛剛說的這個場景,顯然是原料藥企業疼惜制劑客戶,不想因為自己變更了生產場地造成別人要進行供應商變更的工作。但是,既然發生了變更,總是要進行科學合理的評估和研究的,制劑持有人也應當對變更前后的原料藥的質量有自己的風險判斷。
第二個前提,法規背景: 目前國內的藥品生產監管法規中,藥監部門不監管中間體的生產企業,它和化學品制造企業是一樣的存在,至多在延伸檢查的時候被查到;然而,起始物料是GMP的起點,也是注冊申報的起點,中間體作為中間產品,當然在GMP管理范圍,也在注冊申報的工藝中。因此不存在中間體的生產場地轉移問題,該問題本質就是原料藥生產場地轉移的問題。
我們先不管是否合規,想一下可能的路徑和方式:
方式一:按變更原料藥生產場地的中等變更,直接報省局備案
方式二:縮短反應路線,變更后將原來的中間體變成起始物料
方式三:A委托B生產前3步中間體
方式四:以B公司生產前3步中間體,A公司生產后2步,重新申報(登記)該原料藥,A公司為登記的生產企業
然后我們從法規的角度看一下可行性:
方式一:直接報變更備案
無論從什么角度看,方式一都是最優的選擇,變更程度最低,變更成本最低,許可成本最低,也最不繞彎子。
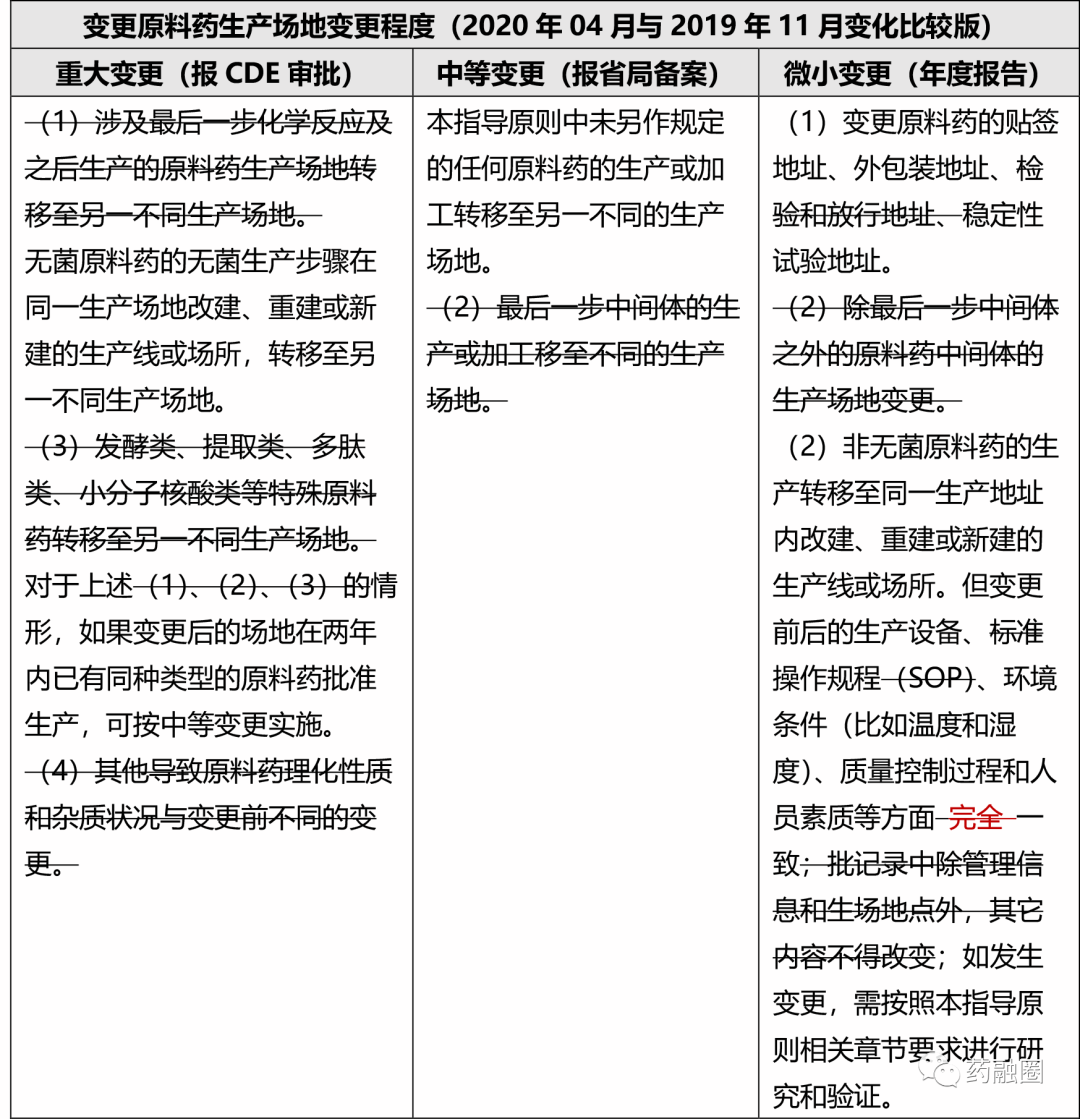
看了這個場景,我們更能明白,為什么CDE終究將2019年原來一版藥學變更指導原則中,原料藥生產場地變更里那一套針對中間體的設置,給推倒重來了。
N-2步中間體變到另一個生產場地定為微小變更,把N-1步中間體變更定為中等變更,把最后一步的場地變更定為重大變更,某種程度上割裂了從起始物料開始的生產質量管理。該版征求意見稿是鼓勵保證完整的生產質量管理的,但是,并不否定可以有部分工序生產場地變化,并且原料藥的生產本來就很少從頭到尾在同一棟樓里,微小變更所述的同一地址新建一個生產場所,往往也是針對某幾步反應的生產場所。
GMP符合性
起始物料是GMP管理的起點。轉移后的生產場地是否是符合GMP的生產企業,如何開展質量管理,如何保證整個生產過程仍然符合GMP,是一個問題。
中間體生產單位的資質問題
經營范圍是否包含中間體的生產銷售。
質量體系管理為此所做的努力
由于A和B是兩家企業,而該原料藥的整個生產過程,從起始物料開始進入生產質量管理,因此,有一套有效的質量保證體系,完善的審計、驗證的執行,是審評及監管方同意這套方案的前提。這需要廠家A的質量體系管理為此作出優秀的表現。
在監管方面需要和省級監管部門充分溝通,中間體不是一個藥品監管部門的明確監管對象,但是一個GMP的藥品生產企業B生產的中間體,是應當能夠接受與藥品同等生產質量要求的監管的。
這個方式雖然最優,但是仍存在風險。
第一,正式的藥學變更指導原則尚未下發,目前我們手上僅有的信息是三個征求意見稿(《已上市藥品藥學變更技術指導原則》《已上市化學藥品變更事項及申報資料要求》《化學藥品變更受理審查指南》)和一個已發布的藥品注冊申報軟件(2020版)(下圖是申報軟件補充申請表中的境內生產的化學藥品的補充申請事項分類),但是由于正式版本尚未發布,隨時存在變化的可能性。

第二,由于地方省級局監管的要求可能不同,在跨省去進行這類變更,面臨和雙方省級局溝通監管事項,也存在監管上一定的不確定性。
方式二:中間體變起始物料
方式二涉及A廠家的重大變更——縮短反應路線。并且方式二還有各種花式的分支劇情。比如:
1)B廠家按藥品生產質量管理規范,提供一套終點為中間體的、完整的生產研究驗證、質量控制、穩定性等研究資料,供應A廠家作為起始物料。
2)該原料藥整個生產過程全部變更到另一個生產場地,批準后,將B廠家生產的中間體作為A廠家生產原料藥的起始物料。
3)B廠家向海外注冊該中間體的DMF等,以一個成熟的經歐美認證的醫藥中間體,提供全套技術文件,作為A廠家的起始物料。
起始物料選擇的合理性(ICHQ11)
變更后將原來的中間體變成起始物料,有可能不能符合ICHQ11對于原料藥起始物料選擇的原則。但是如果經逐條核對,結合優秀的質量控制,該起始物料的選擇仍然符合Q11的要求的話,是有機會進行注冊申報的。
完善的供應商管理和審計
在我國藥品管理的對象里是沒有“醫藥中間體”的,化學藥品的管理只有藥品、原料藥。方式二的管理難點在于,起始物料的身份是一個化學品,對其管理和審計需要廠家A具有完善的供應商管理和審計體系,并能很好地執行。并且廠家B作為重要的起始物料供應商也是有被延伸監管和檢查的可能性的。
方式三:A委托B生產中間體
方式四:A和B合作重新申報該原料藥
委托關系合規性
由于《藥品生產監督管理辦法》規定,經批準或者通過關聯審評審批的原料藥應當自行生產,不得再行委托他人生產。因此,批準后再委托,委托關系是不成立的。但是重新申報就不一樣了,如果A可以把B納入自己產品的生產質量控制體系,重新申報該生產工藝,理論上就不違背《藥品生產監督管理辦法》對這方面的規定。因此上述的方式三如果不是重新申報,是應排除的;方式四可以考慮。
質量體系管理為此所做的努力
和方式一一樣,方式四也是考驗原料藥生產企業的質量體系管理為此所做的加強管理和內控的水平的。
小結:這是個目前沒有官方明確答復的問題,主要討論解決問題的思路,關于轉移的注冊合規性的考慮,以最終下發的《已上市藥品藥學變更技術指導原則》《已上市化學藥品變更事項及申報資料要求》《化學藥品變更受理審查指南》為準。
來源:藥融圈








