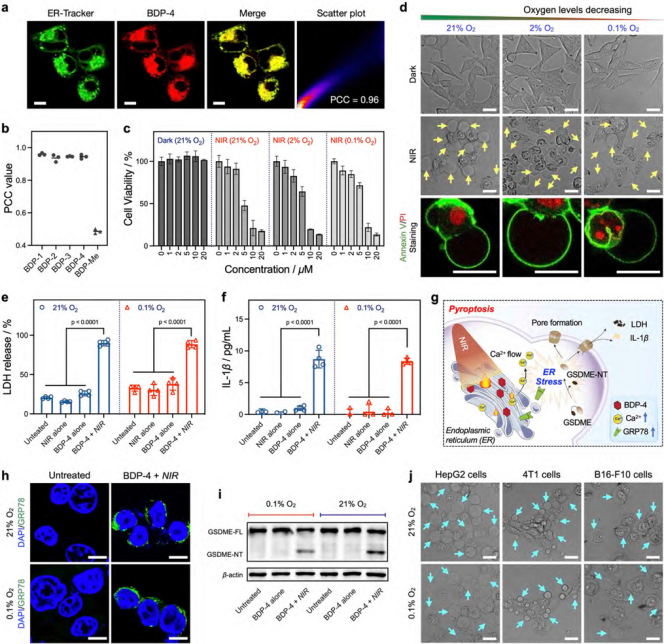
特異性殺傷腫瘤細胞可以安全地根除腫瘤,從而最大限度地減少對正常組織的脫靶損傷;而特異性地誘導腫瘤細胞發生免疫原性死亡(ICD),而非通常的非免疫原性凋亡,可以激活機體的抗腫瘤免疫反應,進一步清除殘余癌細胞(包括轉移灶)。作為一種新興的免疫原性死亡形式,細胞焦亡(Pyroptosis)引發了人們的關注,癌細胞焦亡伴隨著腫瘤抗原脫落以及一系列損傷相關分子模式(DAMPs)和促炎因子的釋放。它們共同促進抗腫瘤免疫響應(包括促進DC細胞成熟、T淋巴細胞的活化與增殖等),從而捕殺殘余癌細胞。 近日,南開大學李昌華教授團隊開發了一種全新的分子設計平臺,實現了激活型近紅外光熱焦亡誘導試劑的靈活定制(圖1)。
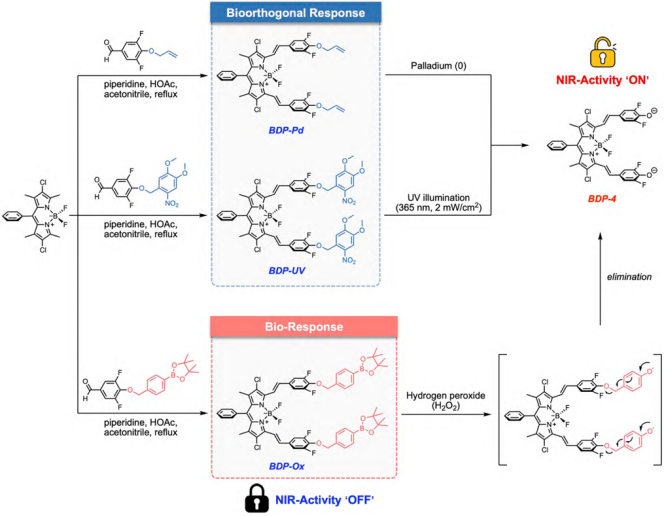
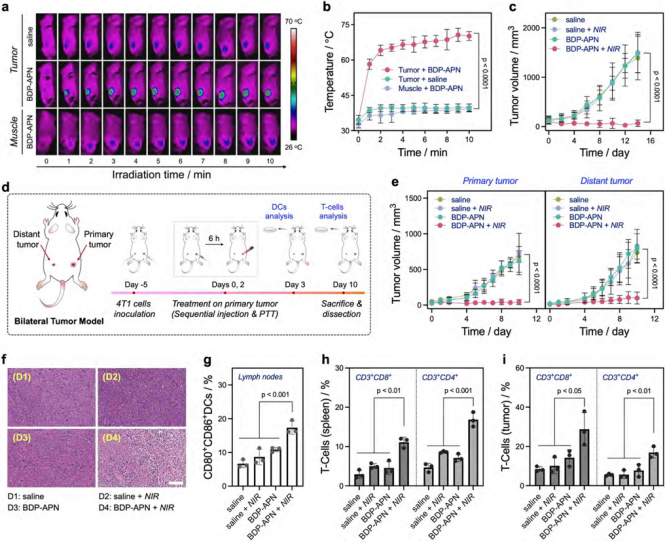
圖1.激活型近紅外光熱免疫激動劑的設計策略與作用機制 該平臺的核心是一種精心設計的PTA骨架(BDP-4),它同時具備內質網靶向和可調節的近紅外光熱活性雙重功能。BDP-4能夠在近紅外光作用下對內質網造成特異性光熱損傷,誘導內質網應激,引發GSDME依賴的細胞焦亡(圖2)。 圖2. BDP-4的內質網靶向性和引發細胞焦亡機制的研究 基于酚羥基的籠蔽/脫籠(Caging/Uncaging)化學,通過安裝不同的籠蔽基元,該分子骨架的內質網靶向性和近紅外活性都能按需調制(包括腫瘤標志物刺激或生物正交刺激)。這種設計極大增強了光療的時空可控性,并為解決光療過程中脫靶損傷問題提供了更高效的解決方案(圖3)。 圖3. 生物正交和生物刺激物響應的近紅外光熱免疫激動劑 活體實驗結果表明,該平臺可特異性誘導腫瘤細胞焦亡,引發機體抗腫瘤免疫反應,增效腫瘤免疫治療,提高生物安全性(圖4)。 4. 小鼠乳腺癌的光熱免疫治療評估 該激活型近紅外光熱免疫試劑平臺的通用性和可調節性為針對不同腫瘤標志物和腫瘤微環境的響應型近紅外光熱試劑的設計和開發奠定了基礎,同時也為實體瘤的個體化光免疫治療開辟了新的研究途徑。 論文信息 Unlocking the Power of Photothermal Agents: A Universal Platform for Smart Immune NIR-Agonists for Precise Cancer Therapy Hao Zhang, Xiaona Xu, Yahui Cao, Zihui Chen, Weiqing Liu, Dr. Xinyi Lu, Prof.?Dr. Changhua Li Angewandte Chemie International Edition DOI: 10.1002/anie.202424830