DNA酶(DNAzyme)作為一類具有催化功能的核酸分子,可通過特異性識別并切割腫瘤相關mRNA分子,在腫瘤的分子診斷與靶向治療領域展現出革命性應用前景。然而,細胞內金屬輔因子(如Mn2+)不足,滿足DNAzyme激活的催化需求,限制了其生物醫學轉化應用。
近日,中國科學院生態環境研究中心彭漢勇團隊創新構建了溫度調控型納米顆粒合成體系,通過DNAzyme分子誘導自組裝技術精準調控錳基納米顆粒生長,開發多功能診療一體化DtMnP納米制劑,同步實現腫瘤分子影像可視化與靶向治療協同增效。
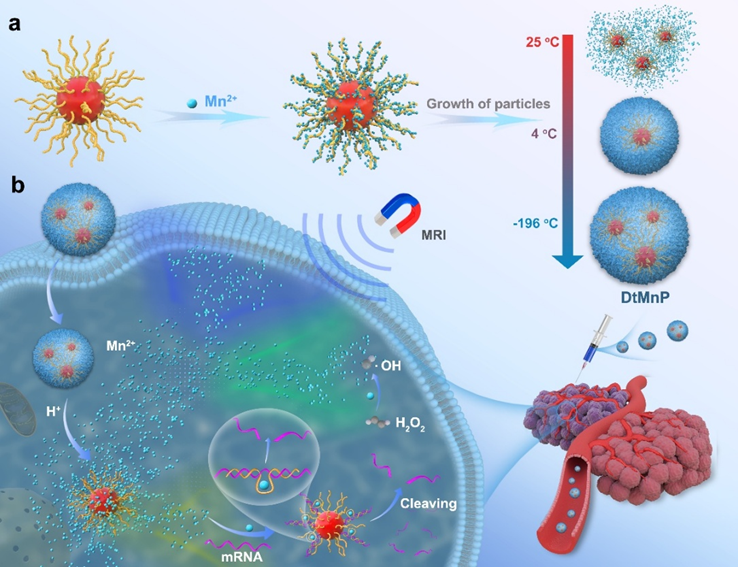
該制備過程包含三個階段:(1)以球形核酸(DNAzyme功能化的金納米顆粒)為支架,通過磷酸配位實現Mn2+可控沉積,引發碳酸錳的異相成核;(2)通過調節溫度來改變碳酸錳的溶解常數(Ksp),在液氮條件下快速冷凍促使納米顆粒沿DNA模板生長;(3)冷凍干燥使納米顆粒穩定,便于長期穩定保存,避免了傳統納米顆粒溶液常見的聚集問題。
DtMnP具有pH響應性釋放的特點,在腫瘤微酸環境條件(pH 5.5)下,60分鐘內可釋放出90%的Mn2+。釋放的Mn2+具有雙重功能:(1)觸發磁共振成像(MRI)的信號放大,實現MCF-7腫瘤的成像,并具有良好的生物安全性;(2)通過DNAzyme介導的EGR-1基因沉默(使mRNA下調60%),并結合Mn2+催化的芬頓反應產生具有細胞毒性的羥基自由基實現化學動力治療(使MCF-7細胞凋亡率達到45%),從而發揮協同治療的功效。
該溫度調控型核酸導向合成策略創新性地建立了一種普適性平臺技術,不僅實現了多功能納米顆粒的可控構筑,更通過核酸序列的模塊化與功能化設計構建了靈活可編程的載體系統,顯著提升了診療功能元件的按需組裝能力。這種兼具腫瘤微環境響應特性和結構穩定性的納米體系,為發展"診-療"聯動的一體化納米制劑提供了創新性技術路徑。
論文信息
Spherical Nucleic Acids-Directed Cryosynthesis of Manganese Nanoagents for Tumor Imaging and Therapy
Wenjing Xie, Qiangjun Hao, Zi Ye, Rui Sha, Bei Wen, Hailin Wang, Hongquan Zhang, Guohua Jia, X. Chris Le, Guibin Jiang, Hanyong Peng
Angewandte Chemie International Edition
DOI: 10.1002/anie.202503004








