近年來,雙環丁烷(BCBs)的環化反應作為一種高效構建飽和3D骨架分子的方法,得到廣泛發展。其中,BCBs的(1,3)環化由于具有構建雙環[n.1.1]骨架(生物電子等排體)的能力而發展最多,但目前的研究主要集中于構建n ≤ 3的小環骨架,對于構建n > 3的中環以及大環骨架相對困難,相關報道較少。此外,還存在BCBs的(1,2)環化以及(1,2,3)環化這兩種環化模式,由于這兩種環化模式涉及相對惰性的BCBs二號位碳原子,所以發展較為緩慢,特別是BCBs的(1,2,3)環化反應,目前為止尚未被報道。
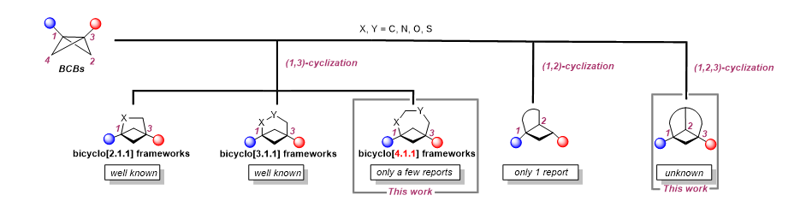
在此研究背景下,華東理工大學施敏教授與中國科學院上海有機化學所魏音副研究員合作報道了一種可見光介導的分子內去芳構化策略,成功構建了雙環[4.1.1]骨架,并首次實現了BCBs的(1,2,3)環化。
該策略將稠環芳烴(蒽或萘)與BCBs連接的底物,通過以下步驟實現多樣化的環化反應:首先經過能量轉移(EnT)過程生成稠環芳烴三線態雙自由基中間體,隨后經分子內環化以及系間竄越生成關鍵的開殼層單線態雙自由基中間體。該中間體可能發生[4π+2σ]環加成過程以構建雙環[4.1.1]骨架,或發生分子內1,4-氫原子轉移(HAT)生成環丁烯中間體,再通過后續的[2π+2π]環加成反應實現BCBs的(1,2,3)環化。實驗觀察發現,蒽基底物僅發生[4π+2σ]環加成過程;萘基底物的反應路徑則受BCBs橋頭取代基影響,當BCBs橋頭為芳基時傾向于發生[4π+2σ]環加成過程,而當BCBs橋頭為烷基則傾向于發生1,4-HAT過程。上述機制得到控制實驗、同位素標記實驗、動力學研究、循環伏安測試、Stern-Volmer實驗等一系列機理實驗和密度泛函理論(DFT)計算的支持;此外,理論計算還揭示了BCBs橋頭取代基對反應選擇性影響的根本原因。
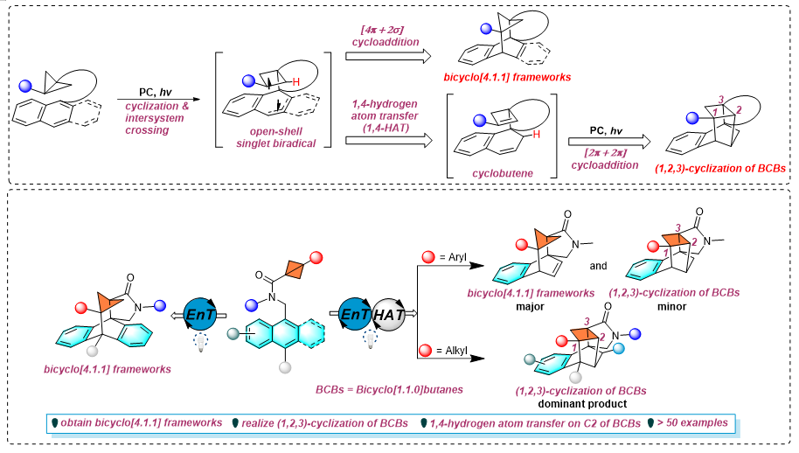
在該工作中,作者將稠環芳烴(蒽和萘)與BCBs連接到同一分子中,通過可見光催化EnT過程成功構建了雙環[4.1.1]骨架,并首次實現了BCBs的(1,2,3)環化,除此之外還發現BCBs的橋頭取代基對產物的選擇性具有決定性作用。該反應為合成多環3D骨架提供了一種新的有效途徑,并為理解和控制反應選擇性提供了機理見解。
論文信息
Visible-Light-Mediated Intramolecular Dearomatization of Naphthalene and Anthracene with Bicyclo[1.1.0]butanes through Energy Transfer Catalysis
Zi-Yu Xu, Xin-Tao Gu, Yin Wei, Min Shi
Angewandte Chemie International Edition
DOI: 10.1002/anie.202506073








