分享一篇發表在Nature Genetics上的文章,文章的題目為“KDM4C inhibition blocks tumor growth in basal breast cancer by promoting cathepsin L-mediated histone H3 cleavage”,通訊作者為來自美國丹娜-法伯癌癥研究所的Kornelia Polyak教授,其團隊研究方向為乳腺癌分子機制解析。

基底乳腺癌是一種預后較差的乳腺癌亞型,目前缺乏有效的治療手段。組蛋白賴氨酸去甲基化酶KDM4C在三陰性乳腺癌(TNBC)中經常發生擴增,但其在腫瘤發生發展中的具體作用及機制尚不明確。
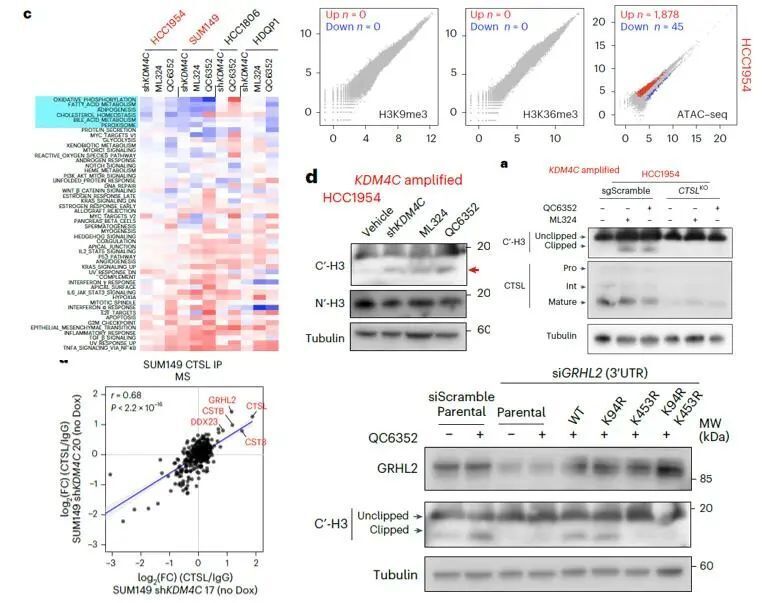
作者發現KDM4C在基底TNBC中頻繁擴增,其表達水平與腫瘤細胞的生長和增殖密切相關。抑制KDM4C可顯著抑制KDM4C擴增的基底乳腺癌細胞的體外生長和體內腫瘤形成能力,且這種抑制作用依賴于KDM4C的去甲基化酶活性。由此作者希望進一步探索具體的作用機制。
然而,KDM4C抑制并未顯著改變其經典底物H3K9me3和H3K36me3的水平,但卻引起了廣泛的染色質可及性變化和轉錄組重塑。作者通過質譜和免疫印跡發現,KDM4C缺失會導致組蛋白H3的N端尾部被組織蛋白酶L(CTSL) 特異性切割,從而影響染色質結構和基因表達。
進一步,作者發現KDM4C抑制會促進轉錄因子GRHL2在453位賴氨酸點發生甲基化,甲基化的GRHL2能夠招募CTSL到染色質上,進而導致CTSL介導的組蛋白H3切割。而CTSL敲除可逆轉KDM4C缺失誘導的腫瘤生長抑制和染色質變化,表明CTSL在這一過程中起關鍵作用。
此外,作者發現KDM4C抑制通過CTSL介導的組蛋白H3切割,下調了谷氨酸-半胱氨酸連接酶(GCLC)的表達,導致谷胱甘肽(GSH)合成減少和活性氧(ROS)水平升高。ROS的積累進一步促進CTSL活性,形成正反饋循環,最終抑制腫瘤細胞生長。

總之,本研究揭示了KDM4C在基底乳腺癌中通過調控CTSL介導的組蛋白H3 切割和氧化還原平衡來促進腫瘤生長的新機制。這一發現不僅拓展了對KDM4C 功能的認識,還為基底乳腺癌的治療提供了新的靶點,即靶向KDM4C-CTSL-GSH軸。
本文作者:LJF
責任編輯:LZ
DOI:10.1038/s41588-025-02197-z
原文鏈接:https://doi.org/10.1038/s41588-025-02197-z








