取代的芳胺、酰基芳胺及芳醚類化合物在藥物化學中有著重要的作用, 長期以來 一直沒有一個較為通用的、溫和的方法制備他們。近幾年來,Buchwald 和 Hartwig 課題針對金屬催化的芳胺、酰基芳胺及芳醚化研究取得很大進展,形成了一類成熟的合成方法。
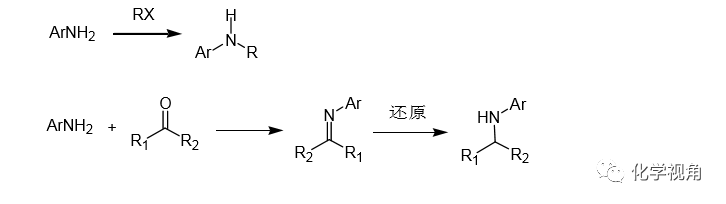
一般取代芳胺的合成以前主要有以下兩種方法:一是從芳香胺出發,通過烷基化或還原胺化等方法可以獲得。但鹵素烷基化很難用于合成不同的雙取代和環烷基的芳胺;還原胺化對于位阻酮及芳香酮,反應很難進行。同時這一方法無法用于二芳胺和三芳胺的合成。
 另一種方法為 Ullmann 縮合,反應中需要高溫,對于有敏感基團的化合物則不能使用。
另一種方法為 Ullmann 縮合,反應中需要高溫,對于有敏感基團的化合物則不能使用。
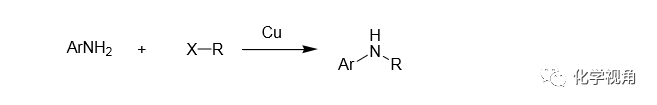
1983 年 Migita等首次報道用鈀催化進行芳胺化反應,但此反應需用定量的錫試 劑,錫試劑為有毒物,為這反應的明顯不足之處。且此反應僅限于仲胺。

1995 年 Buchwald和 Hartwig 報道了鈀催化芳鹵代物的胺基化反應。
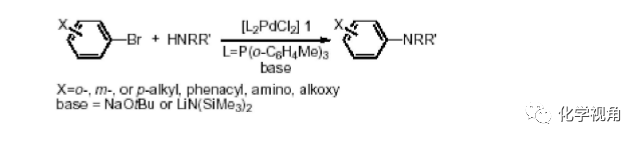
經過近幾年的研究和發展,鈀催化芳胺化反應已取得很大進展,形成了一類成熟的 合成方法,我們稱之為 Buchwald-Hartwig 芳胺化反應。反應的機理如同其它鈀催化的 反應,分為氧化,加成,消除反應,如下圖所示:

如圖中左邊所示,在鹵素被消除生成芳烴及胺的消除生成亞胺是其經常的副反應。 這類反應目前已被廣泛應用在有機合成中。相對于其它的芳胺化反應,此反應對底物有廣泛的適用性。對于富電子或缺電子的溴苯類化合物,吡啶溴化物,對于脂肪伯胺、 仲胺,芳香伯胺、仲胺,吡啶胺甚至吡咯均有很好的收率。
影響 Buchwald 反應的因素
1、 芳香環的離去基團對反應的影響
一般來說碘化物的活性高于溴化物,溴化物的活性高于氯化物。氯化物相對于溴化 物反應需要更高的溫度。后者在常溫下即能反應,前者則需要高溫 。
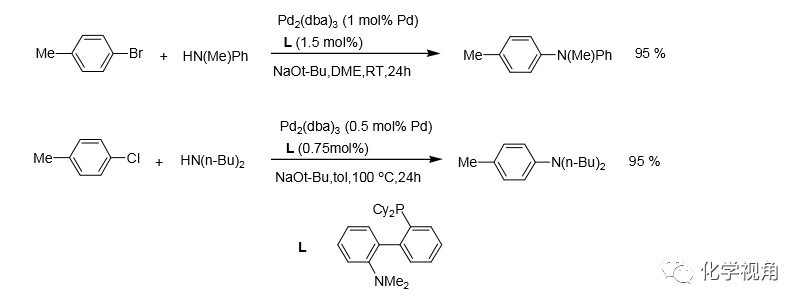
與溴苯類似,苯基三氟甲磺酸酯和胺也可以反應生成苯胺。采用和溴苯類似的反應條件,對于中性或富電子的三氟甲磺酸酯都有較好收率。但對于缺電子的三氟甲磺酸酯收率卻較低,原因是叔丁醇鈉會水解掉部分三氟甲磺酸酯,用碳酸銫代替叔丁醇鈉則 可避免水解,也可得到高的收率。

2、 取代基團電子性對反應的影響
推電子或吸電子取代的苯的溴化物都有較好的收率,吡啶溴化物也有較好的收率。
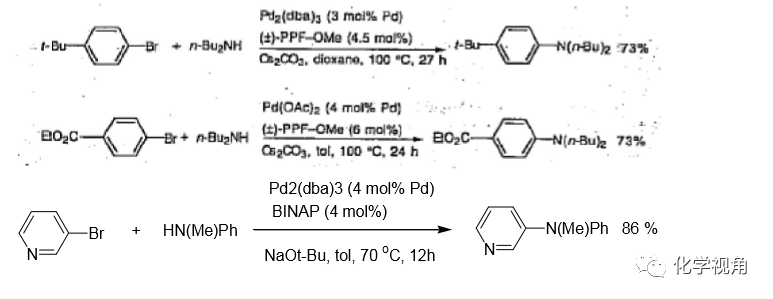 3、配體對反應的影響
3、配體對反應的影響
配體對反應的影響很大,不同的配體收率差別很大。而且針對什么樣的底物用什 么配體,沒有一個清楚的規律,這也是 Buchwald-Hartwig 芳胺化反應一個最大的遺憾。因此有時對不同的底物在做反應時經常要對反應的配體進行優化。 一般常用的鈀催化劑為:Pd2(dba)3, Pd(OAc)2 配體為:P(t-Bu)3, BINAP, P(o-tolyl)3, Xantphos等。

4、對伯胺及仲胺的選擇性
Buchwald 反應還對伯胺和仲胺有一定的選擇性,優先和伯胺反應。
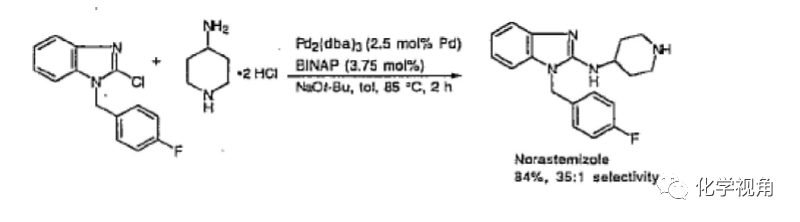
5、對手性的影響
對于α-位有手性的胺,配體對手性的影響很大。P(o-tolyl)3 作配體,ee 值急劇減 少。而用消旋 BINAP,ee值基本沒有減少。









