在自然界以及實驗室中,運用非共價相互作用來控制反應的立體選擇性是一種強有力的手段,然而,由于對這些弱相互作用的作用模式還沒有明確的理解,也限制了其在不對稱自由基化學中的應用。目前已經報道的通過氮自由基形成碳氮鍵的合成方法中,都是利用底物跟手性催化劑之間強的相互作用。近日,美國普林斯頓大學Robert R. Knowles課題組報道了以手性磷酸跟底物形成氫鍵的作用方式,通過質子偶聯電子轉移實現分子內磺酰胺對烯烴的對映選擇性氫胺化。
根據之前已經報道的關于質子偶聯電子轉移(PCET)在氮雜頻哪醇環化以及吲哚氧化活化中的應用(Figure 1a),作者提出,如果使用手性磷酸(Figure 1b),有望將這一方法應用在課題組之前報道的烯烴的分子內氫胺化反應中,從而實現不對稱轉化(Figure 1c)。
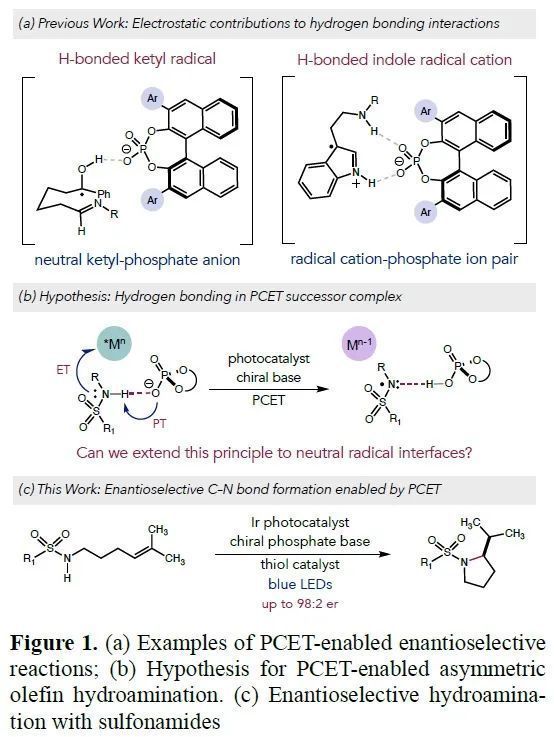
(圖片來源:J. Am. Chem. Soc.)
作者首先選擇4-甲氧基苯基磺酰胺1作為底物,根據之前已經報道的條件,進行手性磷酸配體的篩選。結果顯示,在磷酸酯配體P7作用下反應得到了最優的結果,產率為85%,er值為95/5。然后作者以P7為配體,對反應溫度、H供體、催化劑的量進行微調,都沒有取得明顯的效果。對照實驗顯示其他的試驗參數是不可缺少的(Table 1)。
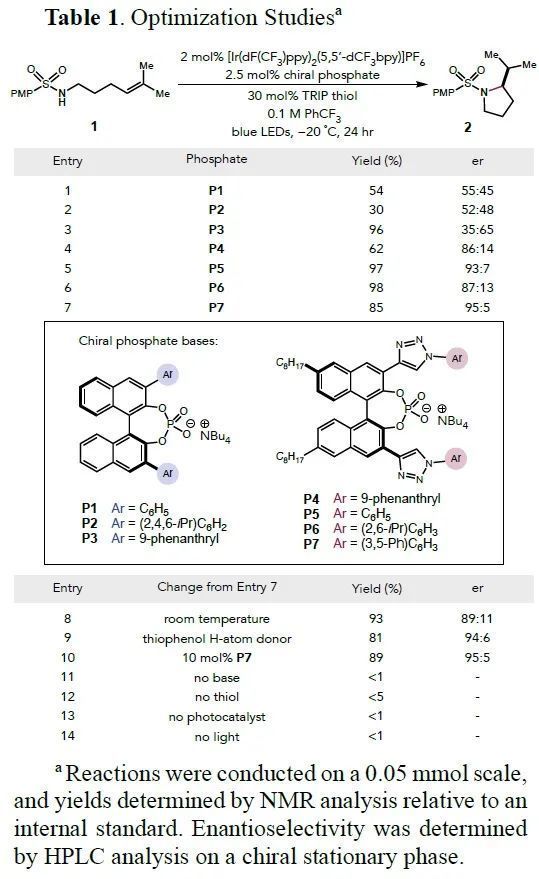
(圖片來源:J. Am. Chem. Soc.)
接下來,作者分別考察了磺酰胺部分和烯烴部分的底物適用范圍,均取得了較好的結果。比較復雜的底物,如19~22,也得到了不錯的產率和er值(Table 2)。
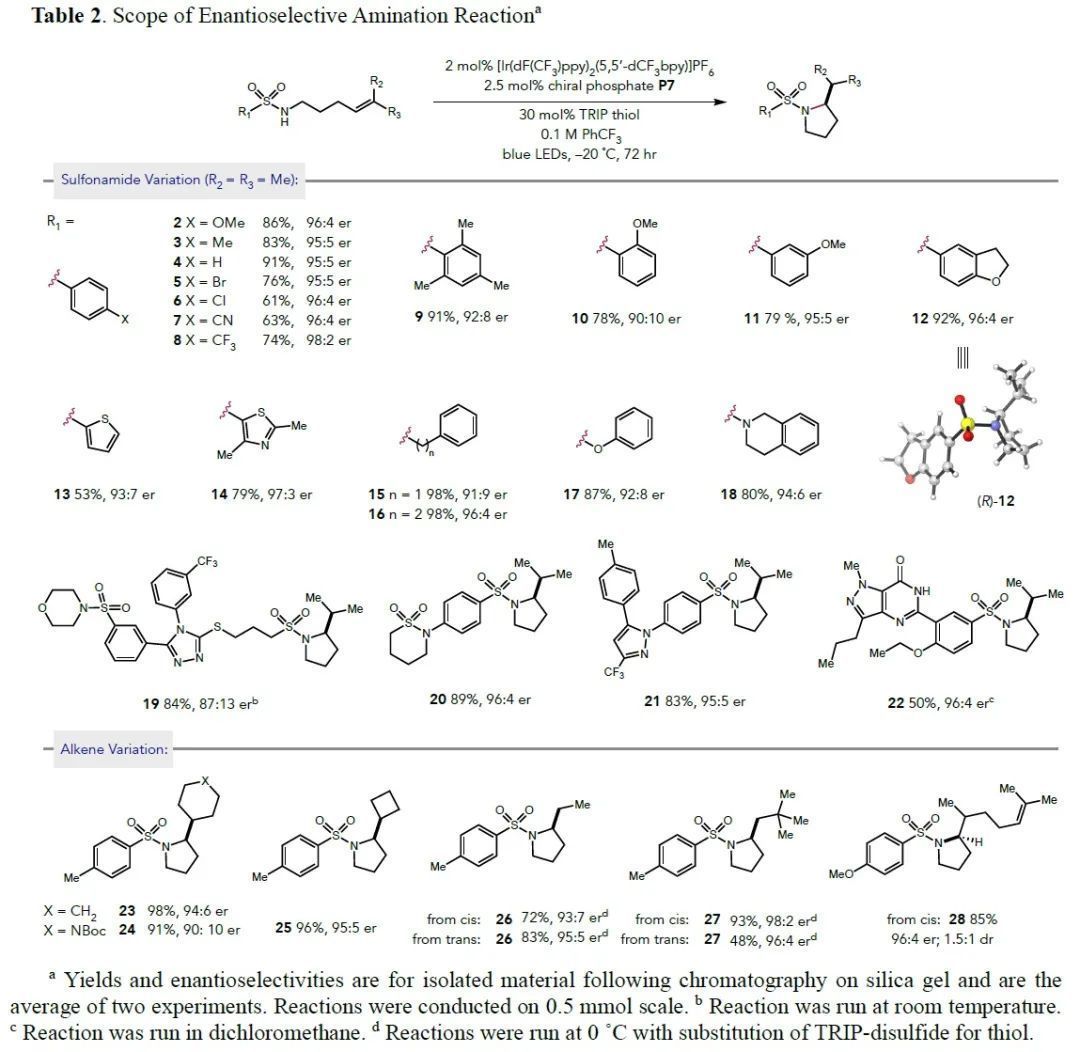
(圖片來源:J. Am. Chem. Soc.)
為了進一步研究這一轉化過程中的立體選擇性控制步驟,作者又設計了底物的胺化反應。用甲基乙烯基酮代替之前使用的硫醇共催化劑,反應得到的碳胺化產物29與之前同一磺酰胺底物反應得到的氫胺化產物的對映選擇性近乎一樣,由此作者認為在這兩個轉化中相同的碳氮鍵形成步驟是反應的立體選擇性控制步驟(Figure 2)。

(圖片來源:J. Am. Chem. Soc.)
最后,作者又嘗試了極性不同的溶劑來測試其對反應立體選擇性的影響。結果顯示,雖然在強極性溶劑中反應的活性大大降低,但立體選擇性在極性和非極性溶劑中都得到很好的保持。反應對溶劑極性不敏感也否定了碳氮鍵形成過程中產生離子對中間體的可能性(Table 3)。

(圖片來源:J. Am. Chem. Soc.)
總的來說,作者利用質子偶聯電子轉移的策略,實現了烯烴的分子內不對稱氫胺化,得到高立體選擇性的吡咯烷產物,此方法具有很好的底物適用性。這項工作也為其它通過非共價相互作用影響自由基中間體立體選擇性的研究提供了很好的借鑒意義。








