【英文名稱】Tri-n-Butylphosphine
【分子式】C12H27P
【分子量】202.32
【 CA 登錄號】998-40-3
【物理性質】 bp 240 °C,mp 30?35°C,d 0.834 g/cm3(20 °C)。溶解于大多數有機溶劑,微溶于乙腈和水。可以用 31PNMR檢測試劑的純度。
【制備和商品】國際大型試劑公司有銷售。
【注意事項】易燃且有臭味,可在惰性氣體保護下室溫。與空氣接觸可以發生自由基鏈反應而被氧化,產生三丁基氧膦和二丁基亞膦酸丁酯。因此,使用前通常需要經過減壓蒸鎦進行純化。
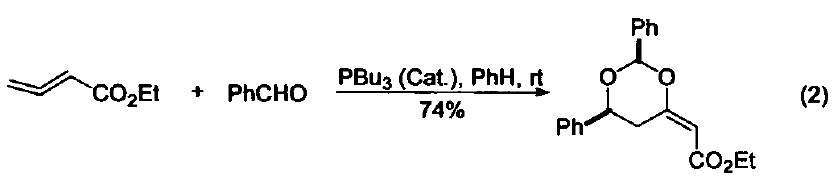
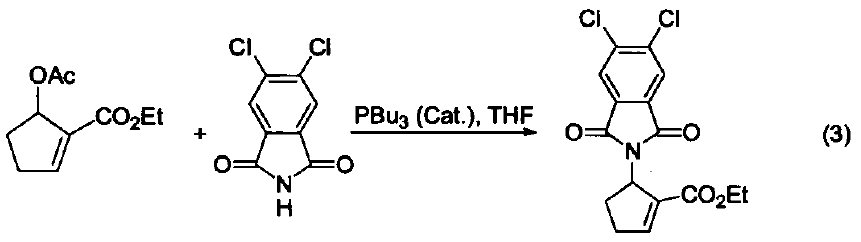
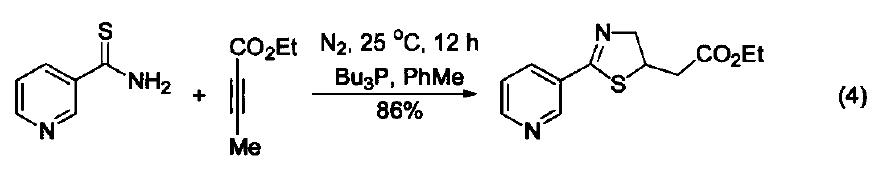
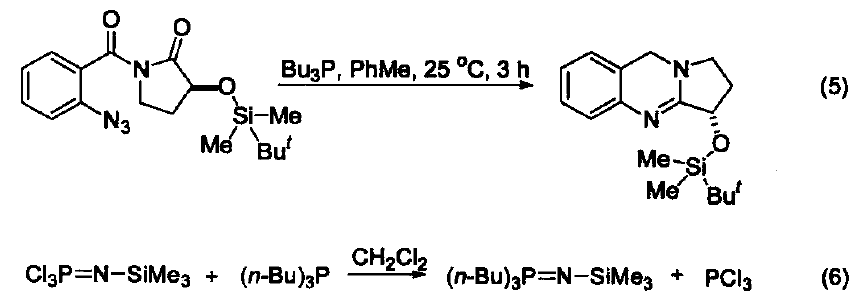
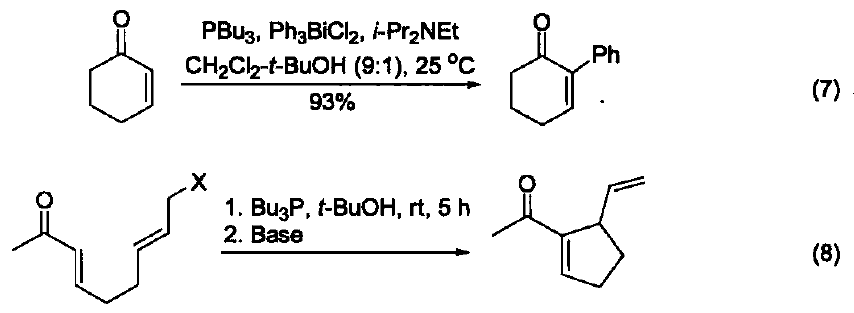
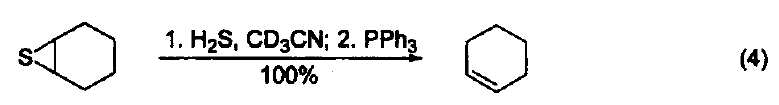
與大多數常用的三配位磷試劑不同,三丁基膦是一種親核試劑。它是相對較弱的堿(在 MeNO3 中pKa=8.70,在甲醇中 pKa = 5.60) 。使用時溶劑不必嚴格除氧,但需要用惰性氣體保護。若暴露在空氣中會發生劇烈的氧化反應,生成三丁基氧膦和二丁基亞膦酸丁酯。 硫醚與硫酯的合成 三丁基膦與二硫化物及醇反應可生成相應的硫醚和Bu3PO,與二硫化物和羧基反應可以得到硫酯(式1)[1]。 催化羰基與烯烴的加成反應 由于三丁基膦具有親核性,進攻雙鍵后會導致電子云的偏移,從而發生加成反應。例如:三丁基膦可以促進苯甲醛與丙二烯的成環反應(式2)[2]。 催化親核取代反應 三丁基膦還可用作親核取代反應的催化劑。例如:它可以催化鄰苯二甲酰胺與烷氧基的取代反應(式3)[3]。 催化1,4-加成反應 三丁基膦也是最常用的1,4-加成反應的催化劑。因為三丁基膦具有親核性和弱堿性,它比其它三配位磷催化劑(例如:三苯基膦等)更適合催化此類反應。因此,三丁基膦是成環反應的重要催化劑之一(式4)[4]。 催化C-X鍵的生成 三丁基膦還可以活化疊氮化合物,從而形成碳-氮雙鍵。這類反應常用于關環等合成路線(式5)[5] 。另外,三丁基膦還可用于疊氮l膦的烷基化反應(式6)[6]。 C-C 鍵的形成 三丁基膦可以催化不飽和烴與芳香化合物的偶聯反應(式7)[7],以及α-位有離去基團的烯烴的偶聯反應。其中,后者常被用作關環反應(式8)[8]。 作為金屬催化劑的配體 三丁基膦可以與一些金屬催化劑共同使用,從而催化不同類型的反應。例如:與Ni生成的配合物可以催化亞磷酸酯的烷基化反應(式9)[9]。 參考文獻 1 Shinada, T.; Yoshida, Y.; Ohfirne, Y. Tetrahedron Lett 1998,39,6027. 2. Zhu, X.-F.; Henry, C. E.; Wang, J.; Dudding, T.; Kwon, O. Org. Lett. 2005, 7,1387. 3. Cho, C.-W.; Kong,J.-R.; Krische, M. J. Org. Lett. 2004, 6, 1337. 4. Liu, B.; Davis, R.; Joshi, B.; Reynolds, D. W. J. Org. Chem. 2002, 67,4595. 5. Eguchi, S.; Suzuki, T.; Okawa, T.; Matsushita, Y.; Yashima, E.; Okamoto, Y. J. Org, Chem. 1996, 61,7316. 6. Rivard, E.; Huynh, K.; Lough, A. J.; Manners, I. J. Am. Chem. Soc. 2004,126,2286. 7. Koecfa, P. K.; Krische, M. J. J. Am. Chem. Soc. 2004,126,5350. 8. Krafft, M. E.; Haxell, T. F. N.7. Am. Chem. Soc. 2005,127,10168. 9. Han, L.-B.; Zhang, C.; Yazawa, H.; Shimada, S. J. Am. Chem. Soc. 2004,126,5080.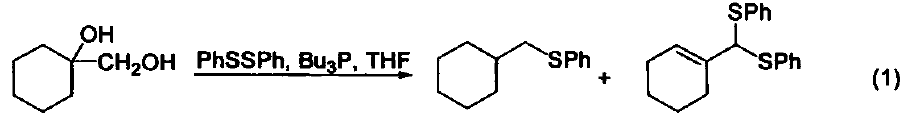
【英文名稱】Triphenylphine 【分子式】C18H15P 【分子量】262.29 【CA登錄號】603-35-0 【物理性質】白色晶體,bp337°C/1.0 mmHg (133.322 Pa), mp 79-81°C, d 1.18g/cm3,溶于大多數有機溶劑,易溶于乙醇,苯,氯仿。極易溶于乙醚,但不溶于水。 【制備和商品】國內外試劑公司均有銷售。可以從正己坑、甲醇或95%乙醇中重結晶,在65°C/1.0 mmHg (133.322 Pa)下經過CaSO4或P2O5干燥后可得到純凈固體。 【注意事項】在劇烈暴曬下會刺激人體,長時間接觸有神經毒性。芳基膦與氧的反應活性比芐基和烷基膦低,但是空氣對于三苯基膦的氧化非常明顯,生成三苯基膦氧化物。三苯基膦不易著火和爆炸,但在加熱分解時會生成有毒的磷化氫和POx煙霧。
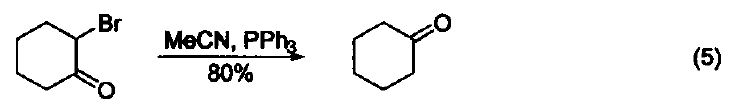
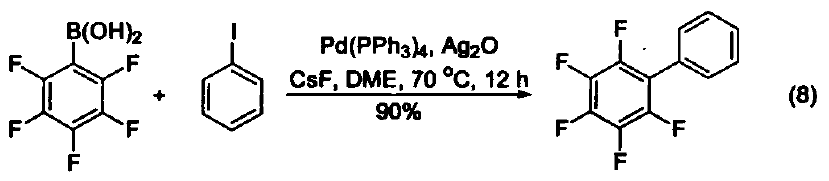
三苯基膦是一種相當常用的還原劑。在大多數情況下,反應都是由生成三苯基膦氧化物(一個熱力學有利的反應)驅動的。另外,三苯基膦廣泛用作金屬催化劑的配體。 脫氧反應 三苯基膦廣泛地應用于過氧化氫或過氧化物的還原反應,生成醇、羰基化合物或環氧化物。這類反應的主要驅動力是三苯基膦與相對較弱的O-O鍵(188-209 kJ/mol)能形成較強的P=O鍵。例如:利用三苯基膦可以還原分解臭氧化物、選擇性制備酮和醛(式1)[1]。 與疊氮化物的反應 三苯基膦與有機疊氮化合物反應生成亞氨基膦烷(式2)[2]。 亞氨基膦烷是一種較活潑的親核試劑,易與親電試劑反應。例如:與醛和酮反應生成亞胺和三苯基膦氧化物。這個反應與 Wittig 反應相似,稱作aza-Wittig反應,這個反應的驅動力也是由于三苯基氧膦的生成(式3)[3] 與有機硫化物的反應 在室溫下,三苯基膦可以將環硫化合物轉變成為烯烴(式4)[4]。 脫鹵反應 α-溴代酮與三苯基膦反應生成酮(式5)[5]。 與有機環氧化物的反應 在水和丙酮溶劑中回流,三苯基膦可以將環氧化合物在疊氮化鈉參與下轉變為環胺化合物(式6)[6]。 取代吡咯的制備 苯胺、呋喃二酮與三苯基膦反應生成1-苯基-2,5-吡咯二酮(式7)[7]。 用作金屬催化劑的配體 三苯基膦可以作為配體與許多過渡金屬組成金屬催化劑。例如:Pd(PPh3)4就是一種重要的催化劑[8],常用于催化偶聯反應。這些偶聯反應是構建碳-碳鍵的重要方法,其特點是催化條件溫和。又例如:在 Pd(PPh3)4 和Ag2O的共同作用下,苯硼酸與芳香鹵代烴直接反應生成聯苯類化合物,該反應的產率可達 90 % ( 式8)[9,10]。除了苯硼酸和鹵代物以外,鎂試劑[11]、鋅試劑[12]、錫試劑[13]、硅化合物[14]等均可作為偶聯反應的底物。 參考文獻 1. Trost, B. M.; Machacek,M. R.; Tsui, H. C.J. Am. Chem. Soc. 2005,127, 7014. 2. Gololobov, Y. G.; 23imurova, I. N.; Kasukhin, L. F. Tetrahedron 1981,37,437. 3. Jean-Louis, C.; Jean-Pierre, F.; Claudine, F.; Paul, T. Org. Bioorg. Chem. 2003,1, 1591. 4. Josemon, J.; James, H. E. Chem. Commun. 1999,1003. 5. Naoshi, K.; Hiroshi, T.; Yasutaka, I. Chem. Lett. 1992,293. 6. Dalili, S.; Yudin, A. K. Org. Lett. 2005, 7, 1161. 7. Pal, B.; Pradhan, P. K.; Jaisankar, P.; Giri, V. S. Synthesis 2003,10, 1549. 8. 綜述文獻見:(a) Suzuki, A. J. Org. Chem. 1999, 64, 147. (b) Jwanro, H.; Marc, S.; Christel, G.; Emmanuelle, S.; Marc, L. Chem. Rev. 2002,102,1359. 9. Korenaga, T.; Kosaki, T.; Fukumura, R.; Ema, T.; Sakai, T. Org. Lett. 2005, 7,4915. 10. Flaherty, A.; Trunkfield, A.; Barton, W. Org. Lett. 2005, 7,4975. 11. Uemura, M.; Takayama, Y.; Sato, F. Org. Lett. 2004, 6,5001. 12. Pei, J.;Ni, J.; Zhou, X.-H.; Cao, X.-Y.; Lai, Y.-H. J. Org. Chem. 2002, 67,4924. 13. Shirakawa, E.; Yoshida, H.; Nakao, Y.; Hiyama, T. J. Am. Chem. Soc. 1999,121,4290. 14. Mowery, M. E.; DeShong, P. J. Org. Chem. 1999, 64, 1684.
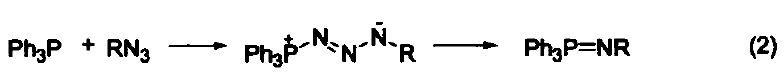
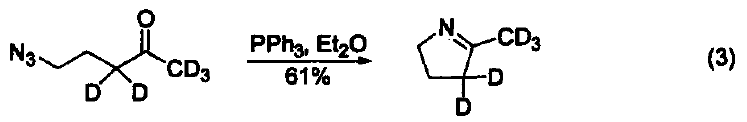
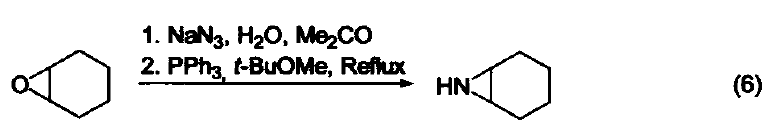
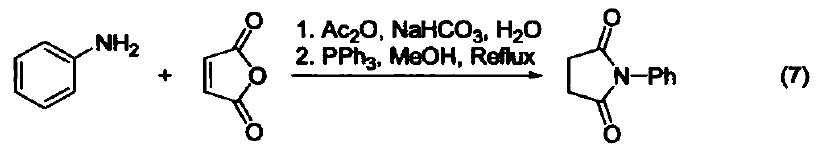
【英文名稱】Tri-tert-Butylphosphine 【分子式】C12H27P 【分子量】202.32 【CA 登錄號】13716-12-6 【物理性質】低熔點固體,mp 30-35 °C, bp 102-103 °C/13 mmHg (1733.2 Pa),d 0.83~0.84 g/cm 3。 【制備和商品】國際大型試劑公司有銷售,商品化試劑通常是10%的正己烷和1,4-二氧雜環己烷溶液。也可通過叔丁基氯化鎂與三氯化磷在乙醚中反應,然后用叔丁基鋰處理來制備( 式1)[1]。 【注意事項】對空氣非常敏感,必須在低溫下隔絕空氣保存。須在手套箱中或惰性氣體保護下操作。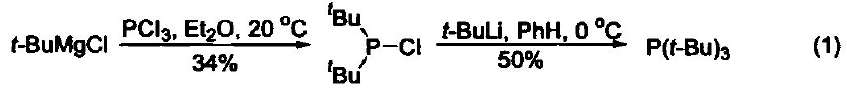
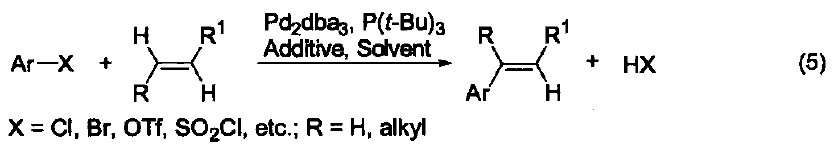
P(t-Bu)3是一個電富性配體,它與鈀生成的配合物可以催化金屬有機化合物(M=B、Sn、Zn、Si、Mg)與芳基鹵化物之間的交叉偶聯反應。這類反應是形成C-C鍵的重要而有效地方法。 傳統的催化劑體系很容易實現鈀對芳基 C-Br 鍵或 C-I 鍵的插入反應,而對于價格更為便宜、性質惰性的芳基 C-Cl 鍵的活化則非常困難。研究發現:加入電富性大的 P(t-Bu)3 配體能夠很有效地實現金屬鈀對芳基C-Cl 鍵的插入反應,這無疑為 C-C 鍵的形成反應注入了新的活力。除了P(t-Bu)3 配體外,能夠活化 C-Cl 鍵的有機配體還有由 Milstein 提出的大體積電富性強的螯合雙膦配體、 Buchwald 提出的大體積電富性強的膦配體、 Herrmann 提出的N-雜環卡賓配體、以及 Beller 提出的亞磷酸鹽配體。 在 P(t-Bu)3 配體的存在下,鈀試劑催化的鹵代芳烴與苯胺底物的胺化反應可以擴展到氯代芳烴(式2)[2]。同時,P(t-Bu)3 也能促進芳基金屬試劑(例如:B、Zn、Sn、Si)與鹵代芳烴或芳基磺酰氯之間的交叉偶聯反應(式3)[3]。 傳統鈀試劑催化的端炔與溴代芳烴之間的Sonogashira反應都是在高溫以及加入共催化劑Cul條件下完成的。加入電富性配體P(t-Bu)3后,不但可以使反應在室溫下進行,還能避免使用Cul,同時也能在高溫下實現氯代芳烴與端炔的反應(式4)[4]。 在P(t-Bu)3配體的存在下,氯代芳烴與單取代或雙取代烯烴也能發生Heck-Mizoroki交叉偶聯反應(式5)[5]。 在P(t-Bu)3配體的存在下,1-芳基三氮烯作為親電試劑也能與芳基金屬試劑(例如:芳基硼、芳基硅)發生交叉偶聯反應(式6)[6]。 參考文獻 1. Hoffmann, H.; Schellenbeck, P. Chem. Ber. 1967,100,692. 2. Yamamoto, T.; Nishiyama, M.; Koie, Y. Tetrahedron Lett 1998,39,2367. 3. Dubbaka, S. R.; Vogel, P. Org. Lett. 2004,6,95. 4. (a) Hundertmark, T.; Littke, A. F.; Buchwald, S. L.; Fu, G. C. Org. Lett. 2000, 2,1729. (b) Kollhofer, A.; Pullmann, T.; Plenio, H. Angew. Chem., Int Ed. 2003,42,1056. 5. Littke,A. F.;Fu,G. C.J. Am. Chem. Soc. 2001,123,6989. 6. Sakei, T.; Son,E.-C.; Tamao, K. Org. Lett. 2004, 6,617.
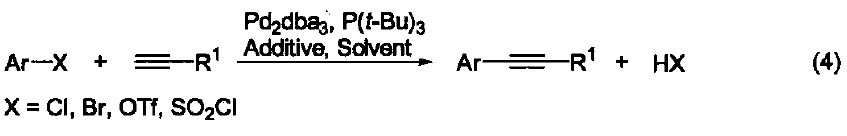
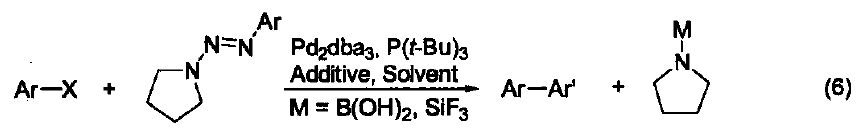
本文摘自---現代有機合成試劑,來源有機化學網








